题目内容
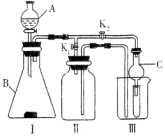
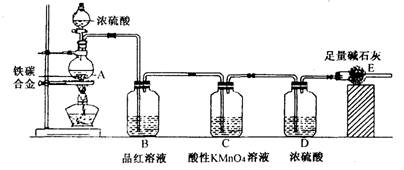
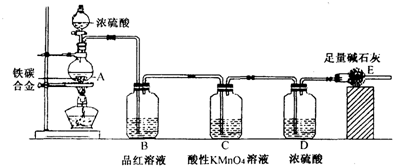
某校化学兴趣小组设计用下图所示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
[查阅资料]:①Fe与浓H2SO4反应,加热,有SO2生成;②C与浓H2SO4反应,加热,有CO2和SO2生成;③SO2可使澄清石灰水变浑浊;④SO2可使品红溶液的红色褪去,而CO2不能;⑤SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能;⑥碱石灰的主要成分为NaOH和CaO.

[实验探究]称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg.下列对实验结果分析正确的是
- A.B装置作用是为了除去反应中生成的SO2
- B.依据实验数据计算得出铁的质量分数为(3b-11m)/11m
- C.装置内的CO2难以赶尽,E质量偏小,导致铁的质量分数偏小
- D.SO2未被酸性KMnO4除尽也可能会引起铁的质量分数偏小
D
分析:根据题意,SO2可使澄清石灰水变浑浊;SO2可使品红溶液的红色褪去,而CO2不能;SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能;碱石灰的主要成分为NaOH和CaO;本实验实验原理是测定产生的二氧化碳的质量,并排除二氧化硫的干扰,需要吸收二氧化硫,并证明二氧化碳已被除尽,据此结合选项描述的内容进行分析判断.
解答:A、根据题意,SO2可使品红溶液的红色褪去,而CO2不能,则B装置作用是为了检验反应中生成的SO2,而不是除去反应中生成的SO2,故选项说法错误.
B、称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为mg×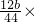 100%=
100%= g,则含铁的质量为mg-
g,则含铁的质量为mg- g=
g= ,铁的质量分数为
,铁的质量分数为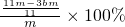 =
= ,故选项说法错误.
,故选项说法错误.
C、装置内的CO2难以赶尽,E质量偏小,会导致铁的质量分数偏大,故选项说法错误.
D、SO2未被酸性KMnO4除尽,会造成E质量偏大,会引起铁的质量分数偏小,故选项说法正确.
故选D.
点评:本题难度不是很大,理解题目所提供新信息、灵活运用所学化学知识是正确解答本题的关键所在.
分析:根据题意,SO2可使澄清石灰水变浑浊;SO2可使品红溶液的红色褪去,而CO2不能;SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能;碱石灰的主要成分为NaOH和CaO;本实验实验原理是测定产生的二氧化碳的质量,并排除二氧化硫的干扰,需要吸收二氧化硫,并证明二氧化碳已被除尽,据此结合选项描述的内容进行分析判断.
解答:A、根据题意,SO2可使品红溶液的红色褪去,而CO2不能,则B装置作用是为了检验反应中生成的SO2,而不是除去反应中生成的SO2,故选项说法错误.
B、称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为mg×
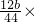 100%=
100%= g,则含铁的质量为mg-
g,则含铁的质量为mg- g=
g= ,铁的质量分数为
,铁的质量分数为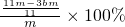 =
= ,故选项说法错误.
,故选项说法错误.C、装置内的CO2难以赶尽,E质量偏小,会导致铁的质量分数偏大,故选项说法错误.
D、SO2未被酸性KMnO4除尽,会造成E质量偏大,会引起铁的质量分数偏小,故选项说法正确.
故选D.
点评:本题难度不是很大,理解题目所提供新信息、灵活运用所学化学知识是正确解答本题的关键所在.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
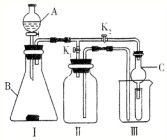 某校化学兴趣小组设计的实验装置如图所示,既可用于制取气体,又可用于验证物质性质.
某校化学兴趣小组设计的实验装置如图所示,既可用于制取气体,又可用于验证物质性质.