题目内容
【题目】水是一种重要的资源。请回答下列问题:
① 活性炭常用于净水,主要利用其___________性。
② 用来检验无水酒精中是否含有水的物质是____________。
③ 打开汽水瓶盖时,汽水会自动喷出来,说明气体在水中的溶解度随_______而减小。
④ 在宏观、微观和符号之间建立联系是化学特有的思维方式。
⑤ 水是一种重要的溶剂,配制100g溶质质量分数为16%的氯化钠溶液,所需水的体积为_______mL(水的密度是1.0g/cm3);溶解时玻璃棒搅拌的目的是__________。
⑥ 甲、乙两种固体物质(不含结晶水,且不与水反应)的溶解度曲线如下图。
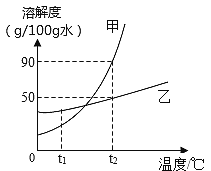
(I)甲、乙两种物质中溶解度受温度影响较大的是___________物质。
(Ⅱ)若将t2℃时甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法是_________。(任写一种即可)
(Ⅲ)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是____________。
(IV)t1℃时,若将25g乙固体加入50g水中,充分搅拌后,仍有9.2g乙固体未溶解,则t1℃时乙的溶解度为______。
(V)t2℃接近饱和的甲溶液逐渐冷却至t1℃,下图中有关量随时间变化的趋势正确的是________。(选填编号)

【答案】 吸附 硫酸铜(或CuSO4) 压强的减小 84 加速固体溶解速度 甲 加溶质或恒温蒸发溶剂 降温结晶 31.6g/100g水 C
【解析】①根据活性炭有吸附性解答;②根据硫酸铜遇水变蓝分析解答;③根据气体的溶解度受压强的影响分析解答;⑤根据溶剂质量=溶液质量-溶质质量及溶解时玻璃棒的作用是加速固体溶解速度分析解答;⑥(I)根据溶解度曲线分析解答;(Ⅱ)根据不饱和溶液变成饱和溶液的方法分析解答;(Ⅲ)根据溶解度曲线分析解答;(IV)根据溶解度概念分析解答;(V)根据降低温度由不饱和溶液变成饱和溶液且有晶体析出分析解答。① 活性炭常用于净水,主要利用其吸附性;②硫酸铜遇水变蓝,用来检验无水酒精中是否含有水的物质是硫酸铜(或CuSO4);③ 打开汽水瓶盖时,瓶内压强减小,汽水会自动喷出来,说明气体在水中的溶解度随压强的减小而减小;⑤配制100g溶质质量分数为16%的氯化钠溶液,所需水的质量为100g-100g×16%=84g。84g÷1.0g/cm3=84 cm3=84mL;溶解时玻璃棒搅拌的目的是加速固体溶解速度;⑥由图可知,甲物质的溶解度曲线较陡,乙物质的溶解度曲线较平缓。(I)甲、乙两种物质中溶解度受温度影响较大的是甲物质;(Ⅱ)若将t2℃时甲的不饱和溶液变成该温度下的饱和溶液,可采用的方法是加溶质或恒温蒸发溶剂;(Ⅲ)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是降温结晶;(IV)t1℃时,若将25g乙固体加入50g水中,充分搅拌后,仍有9.2g乙固体未溶解,则已溶解的乙物质的质量为15.8g。由此可知,100g水中最多溶解31.6g 。故t1℃时乙的溶解度为31.6g/100g水;(V)t2℃接近饱和的甲溶液逐渐冷却至t1℃时,降低温度由不饱和溶液变成饱和溶液且有晶体析出。A、刚开始降低温度时,没有溶质析出,错误;B、降低温度,溶剂质量不变,错误;C、降低温度,溶液由不饱和变为恰好饱和,然后有晶体析出,到温度为t1℃时为止,故溶质质量分数的图像为不变、下降、不变,正确;D、刚降低温度时,没有晶体析出,错误。故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案