题目内容
(2010?莆田)某同学用100g含碳酸钙90%的大理石与足量稀盐酸发生反应,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.若该实验条件下CO2的密度为1.9g/L,计算生成二氧化碳气体的体积.(计算结果保留1位小数)
分析:根据碳酸钙的质量,代入反应CaCO3+2HCl=CaCl2+H2O+CO2↑中计算二氧化碳的质量,再利用CO2的密度计算体积.
解答:解:碳酸钙质量为100g×90%=90g,
设生成CO2的质量为x,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
90g x
,
解得x=39.6g,
又实验条件下CO2的密度为1.9g/L,
则二氧化碳的体积为
=20.8L,
答:二氧化碳的体积为20.8L.
设生成CO2的质量为x,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
90g x
|
解得x=39.6g,
又实验条件下CO2的密度为1.9g/L,
则二氧化碳的体积为
| 39.6g |
| 1.9g?L-1 |
答:二氧化碳的体积为20.8L.
点评:本题考查学生利用化学反应方程式的计算,学生应学会利用质量分素来计算物质的纯质量,然后将物质的纯质量代入方程式来计算,并注意计算格式的规范性和解答思路的严谨性.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
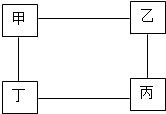 (2010?莆田)如右图所示,甲、乙、丙、丁分别为下列物质中的某一种:盐酸、硫酸、氢氧化钠和碳酸钠,图中直线相连的两种物质或其溶液都能相互发生反应.
(2010?莆田)如右图所示,甲、乙、丙、丁分别为下列物质中的某一种:盐酸、硫酸、氢氧化钠和碳酸钠,图中直线相连的两种物质或其溶液都能相互发生反应.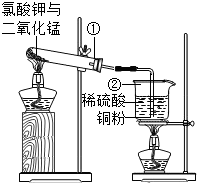 (2010?莆田)已知:2Cu+2H2SO4+O2
(2010?莆田)已知:2Cu+2H2SO4+O2