题目内容
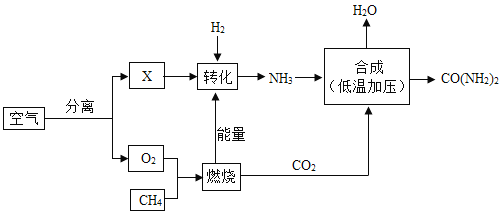
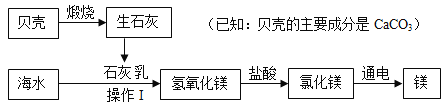
【题目】目前世界上生产的金属镁60%来自于海水。分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2。工业上以苦卤水为原料制取金属镁的流程如下图

(1)生石灰转化为熟石灰的化学反应方程式为_____。
(2)Y的化学式为_____;Y与Z反应生成x,实现了Y的循环利用,X的名称是_____。
(3)烘干后得到的固体MgCl2中可能含有的少量杂质是_____(填写字母编号)。
A Ca(OH)2
B CaCl2
C NaCl
(4)简述用pH试纸测定溶液pH的方法_____。
【答案】CaO+H2O=Ca(OH)2 Cl2 氯化氢 B 用干燥、洁净的玻璃棒蘸取待测液,滴到pH试纸上,待颜色变化稳定后,与标准比色卡对比,读出pH值
【解析】
(1)生石灰(氧化钙)与水反应转化为熟石灰(氢氧化钙)的化学反应方程式为:CaO+H2O=Ca(OH)2
(2)电解氯化镁产生没和氯气。则Y的化学式为Cl2;氯气与氢气反应生成氯化氢,氯化氢溶于水形成盐酸,实现了氯气的循环利用,X的名称是氯化氢;
(3)氢氧化钙属于微溶物,过滤后得到氢氧化镁沉淀的表面附着少量氢氧化钙,加入足量的稀盐酸,氢氧化钙与稀盐酸反应产生氯化钙,烘干后得到的固体MgCl2中可能含有的少量杂质是:氯化钙;
故选:B。
(4)简述用pH试纸测定溶液pH的方法:用干燥、洁净的玻璃棒蘸取待测液,滴到pH试纸上,待颜色变化稳定后,与标准比色卡对比,读出pH值。

练习册系列答案
相关题目