题目内容
NaCl和KNO3溶解度曲线如下图所示,下列说法正确的是( )
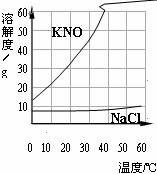
A.KNO3的溶解度大于NaCl的溶解度
B.KNO3的溶解度随温度的升高而增大
C.20℃时,40 g KNO3可完全溶解在100 g水中
D.NaCl溶液的溶质质量分数与KNO3溶液的溶质质量分数不可能相等
B

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
题目内容
NaCl和KNO3溶解度曲线如下图所示,下列说法正确的是( )

A.KNO3的溶解度大于NaCl的溶解度
B.KNO3的溶解度随温度的升高而增大
C.20℃时,40 g KNO3可完全溶解在100 g水中
D.NaCl溶液的溶质质量分数与KNO3溶液的溶质质量分数不可能相等
B

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案