题目内容
【题目】用下图装置进行实验。
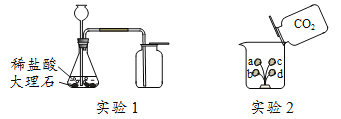
(1)实验1中发生反应的化学方程式为_______。
(2)实验1中将燃着的木条放在集气瓶口,若观察到______________,说明二氧化碳已收集满。
(3)实验2中,a、b为润湿的紫色石蕊棉球,c、d为干燥的紫色石蕊棉球。实验中能说明二氧化碳密度大于空气且能与水反应的现象有_____________________。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 木条熄灭 c、d不变色,b比a先由紫色变为红色
【解析】
(1)大理石主要成分是碳酸钙,盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)二氧化碳不燃烧且不支持燃烧,所以实验1中将燃着的木条放在集气瓶口,若观察到木条熄灭,说明二氧化碳已收集满;
(3)a、b为润湿的紫色石蕊棉球,c、d为干燥的紫色石蕊棉球。c、d不变色,a、b变色。证明二氧化碳不能使紫色石蕊变色,二氧化碳与水反应生成碳酸,碳酸呈酸性,可以使紫色石蕊试剂变红;若b先变红,说明二氧化碳先与下面棉球中水反应,证明二氧化碳的密度比空气大。

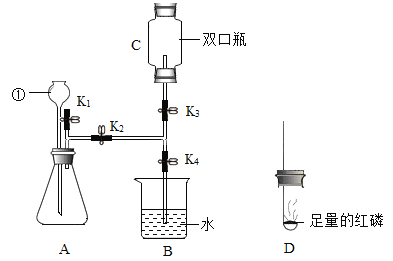
【题目】兴趣小组用如下装置,进行有关碳及其氧化物的化学性质研究(图中夹持仪器已略)。

实验目的 | 实验现象 | 实验分析 |
①连接装置AD,探究碳的化学性质。 | A中固体逐渐减少。 | A中化学方程式_____, D中酒精灯的作用_____。 |
②连接装置ABCEF,探究一氧化碳的化学性质。 | B中现象_____。 E中现象_____。 | B中化学方程式_____, C的作用_____, E的作用_____。 |
【题目】不同温度时,NaCl固体的溶解度如下表所示。20℃时,将50g NaCl固体加入到盛有100g水的烧杯中,充分溶解得到溶液。下列说法正确的是
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |

A.烧杯中溶液的质量为150g
B.烧杯中剩余固体的质量为14g
C.溶液中溶质质量分数的计算式为![]() ×100%
×100%
D.升高温度能将烧杯中的饱和溶液变为不饱和溶液