题目内容
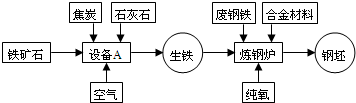
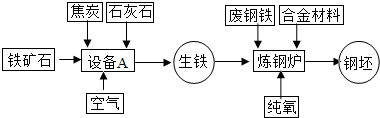 联合钢铁工业的基本生产流程示意图如下:
联合钢铁工业的基本生产流程示意图如下:请回答下列问题:
(1)写出设备A的名称:
(2)写出以赤铁矿为原料在高温下与一氧化碳反应制取铁的化学方程式:
(3)应用化学原理分析,工业炼钢时用纯氧而不用空气的原因是:
(4)铁粉与生石灰都是常用的干燥剂,现欲用化学方法检验某食品袋中的干燥剂究竟是其中的哪一种?请你简述方法和现象:
(5))某赤铁矿石中含Fe2O380%,用3000 t这种矿石,可炼出含杂质4%的生铁质量
分析:(1)(2)(3)根据高炉炼铁的原理及注意事项分析;
(4)根据铁与生石灰化学性质的不同分析;
(5)根据Fe元素守恒计算即可.
(4)根据铁与生石灰化学性质的不同分析;
(5)根据Fe元素守恒计算即可.
解答:解:(1)工业炼钢在高炉中进行.
故答案为:高炉
(2)工业上用一氧化碳冶炼铁.
故答案为:3CO+Fe2O3
2Fe+3CO2
(3)工业炼铁需要高温,燃料在纯氧中燃烧比在空气中燃烧更剧烈,放出的热量更多.
故答案为:促使反应更加剧烈,并获得更多的热量.
(4)铁与稀盐酸反应产生无色气体,但氧化钙与稀盐酸反应无明显现象.
故答案为:加入稀盐酸,有气泡产生的为铁粉,否则为生石灰.
(5)根据反应前后Fe元素守恒,设可炼出含杂质4%的生铁质量为x 则
3000×80%×
=(1-4%)x
解得x=1750t
答:可炼出含杂质4%的生铁质量为1750t
故答案为:高炉
(2)工业上用一氧化碳冶炼铁.
故答案为:3CO+Fe2O3
| ||
(3)工业炼铁需要高温,燃料在纯氧中燃烧比在空气中燃烧更剧烈,放出的热量更多.
故答案为:促使反应更加剧烈,并获得更多的热量.
(4)铁与稀盐酸反应产生无色气体,但氧化钙与稀盐酸反应无明显现象.
故答案为:加入稀盐酸,有气泡产生的为铁粉,否则为生石灰.
(5)根据反应前后Fe元素守恒,设可炼出含杂质4%的生铁质量为x 则
3000×80%×
| 112 |
| 160 |
解得x=1750t
答:可炼出含杂质4%的生铁质量为1750t
点评:在做计算题时经常用到元素守恒法,用此方法可以省去很多中间过程,从而得到简化计算过程的目的,同学们要能够灵活运用!

练习册系列答案
相关题目
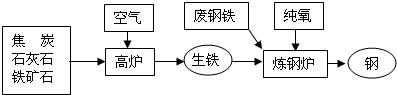
联合钢铁工业的基本生产流程示意图如下,请回答相关问题.

(1)上述3种含铁物质中,属于金属材料的是: ;
(2)铁在氧气中燃烧的化学方程式为:
(3)某同学取赤铁矿样品10g,与足量的一氧化碳充分反应,并将生成的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g.请你根据该同学的实验数据,计算出赤铁矿样品中三氧化二铁的质量分数.
(4)铁制品使用过程中会生锈,情况调查如下:
从调查中可知铁制品生锈的主要条件是 ;工业上常用稀盐酸除去铁锈,反应的化学方程式为: ;下列保护铁资源的建议中,正确的是 .(填字母)
A.防止铁制品腐蚀 B.回收利用废旧铁制品 C.任意开采铁矿石
(5)锰和铁在周期表中位置、相对原子质量(锰是55,铁是56)相近.锰与铁的金属活动性谁更强呢?
实验设计:相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等浓度且足量的稀盐酸中反应,观察现象,填写结论.
除了比较与酸反应产生气体速度的快慢,你还有其他化学方法可比较这二种金属活动性的强弱吗?请举出一种方法(写出原理即可) .

(1)上述3种含铁物质中,属于金属材料的是:
(2)铁在氧气中燃烧的化学方程式为:
(3)某同学取赤铁矿样品10g,与足量的一氧化碳充分反应,并将生成的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g.请你根据该同学的实验数据,计算出赤铁矿样品中三氧化二铁的质量分数.
(4)铁制品使用过程中会生锈,情况调查如下:
| 调查内容 | 掉漆的自行车 | 裸露在混凝土 以外的钢筋 |
涂油的 无锈铁钉 |
镀铬铁质剪刀 |
| 铁制品锈蚀 的现象 |
风吹雨淋,时间长了,掉漆的部分会生锈 | 时间长了钢筋表面出现锈层 | 铁钉较长时间仍不生锈 | 剪刀较长时间不生锈 |
A.防止铁制品腐蚀 B.回收利用废旧铁制品 C.任意开采铁矿石
(5)锰和铁在周期表中位置、相对原子质量(锰是55,铁是56)相近.锰与铁的金属活动性谁更强呢?
实验设计:相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等浓度且足量的稀盐酸中反应,观察现象,填写结论.
| 金属 | 铁 | 锰 |
| 与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度较快 |
| 结论 | ||

 联合钢铁工业的基本生产流程示意图如下:
联合钢铁工业的基本生产流程示意图如下: