题目内容
联合钢铁工业的基本生产流程示意图如下,请回答相关问题.
(1)上述3种含铁物质中,属于金属材料的是:
(2)铁在氧气中燃烧的化学方程式为:
(3)某同学取赤铁矿样品10g,与足量的一氧化碳充分反应,并将生成的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g.请你根据该同学的实验数据,计算出赤铁矿样品中三氧化二铁的质量分数.
(4)铁制品使用过程中会生锈,情况调查如下:
| 调查内容 | 掉漆的自行车 | 裸露在混凝土 以外的钢筋 |
涂油的 无锈铁钉 |
镀铬铁质剪刀 |
| 铁制品锈蚀 的现象 |
风吹雨淋,时间长了,掉漆的部分会生锈 | 时间长了钢筋表面出现锈层 | 铁钉较长时间仍不生锈 | 剪刀较长时间不生锈 |
A.防止铁制品腐蚀 B.回收利用废旧铁制品 C.任意开采铁矿石
(5)锰和铁在周期表中位置、相对原子质量(锰是55,铁是56)相近.锰与铁的金属活动性谁更强呢?
实验设计:相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等浓度且足量的稀盐酸中反应,观察现象,填写结论.
| 金属 | 铁 | 锰 |
| 与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度较快 |
| 结论 | ||
分析:(1)金属材料包括纯金属和合金;
(2)书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须遵守质量守恒定律、依据客观事实;
(3)根据题意,溶液增加的质量5.5g即还原氧化铁生成二氧化碳的质量,根据反应的化学方程式,由二氧化碳质量计算参加反应氧化铁的质量,并完成赤铁矿样品中氧化铁的质量分数的计算;
(4)铁生锈的条件是铁与水和氧气同时接触;保护金属资源的措施是①防止金属的腐蚀②金属的回收利用③寻找金属的代用品④有计划合理的开采矿物;
(5)根据实验现象可以判断金属的活泼性.
(2)书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须遵守质量守恒定律、依据客观事实;
(3)根据题意,溶液增加的质量5.5g即还原氧化铁生成二氧化碳的质量,根据反应的化学方程式,由二氧化碳质量计算参加反应氧化铁的质量,并完成赤铁矿样品中氧化铁的质量分数的计算;
(4)铁生锈的条件是铁与水和氧气同时接触;保护金属资源的措施是①防止金属的腐蚀②金属的回收利用③寻找金属的代用品④有计划合理的开采矿物;
(5)根据实验现象可以判断金属的活泼性.
解答:解:(1)生铁和钢是铁的合金,属于金属材料;
(2)铁与氧气在点燃条件下反应生成四氧化三铁,该反应的化学方程式为:3Fe+2O2
Fe3O4;
(3)设样品中Fe2O3的质量为x.
Fe2O3+3CO
2Fe+3CO2
160 132
x 5.5g
=
解得x=≈6.67g
样品中Fe2O3的质量分数为
×100%=66.7%;
(4)铁生锈的条件是铁与水和氧气同时接触;盐酸除锈的化学方程式为:6HCl+Fe2O3═2FeCl3+3H2O;任意开采铁矿石不正确,应该有计划合理的开采铁矿石;
(5)金属与酸反应的速率越快,金属越活泼.结论:锰比铁活泼;另一种方法:将锰放入硫酸亚铁溶液中观察.
故答案为:(1)生铁、钢;
(2)3Fe+2O2
Fe3O4;
(3)66.7%;(共(4分):化学方程式(1分),设答(1分),比例式(1分),答案1分)
(4)与水和氧气同时接触;6HCl+Fe2O3═2FeCl3+3H2O; A B
(5)金属活动性锰>铁;将锰放入硫酸亚铁溶液(等合理答案).
(2)铁与氧气在点燃条件下反应生成四氧化三铁,该反应的化学方程式为:3Fe+2O2
| ||
(3)设样品中Fe2O3的质量为x.
Fe2O3+3CO
| ||
160 132
x 5.5g
| 160 |
| 132 |
| x |
| 5.5g |
解得x=≈6.67g
样品中Fe2O3的质量分数为
| 6.67g |
| 10g |
(4)铁生锈的条件是铁与水和氧气同时接触;盐酸除锈的化学方程式为:6HCl+Fe2O3═2FeCl3+3H2O;任意开采铁矿石不正确,应该有计划合理的开采铁矿石;
(5)金属与酸反应的速率越快,金属越活泼.结论:锰比铁活泼;另一种方法:将锰放入硫酸亚铁溶液中观察.
故答案为:(1)生铁、钢;
(2)3Fe+2O2
| ||
(3)66.7%;(共(4分):化学方程式(1分),设答(1分),比例式(1分),答案1分)
(4)与水和氧气同时接触;6HCl+Fe2O3═2FeCl3+3H2O; A B
(5)金属活动性锰>铁;将锰放入硫酸亚铁溶液(等合理答案).
点评:本道题综合考查了化学方程式的书写及其金属活泼性比较、金属生锈的条件和保护铁资源的措施,增强了学生节约资源、爱护资源的意识.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
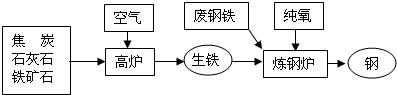
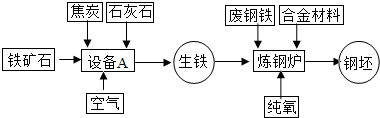

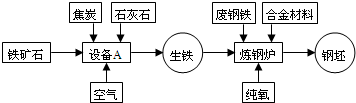 联合钢铁工业的基本生产流程示意图如下:
联合钢铁工业的基本生产流程示意图如下: