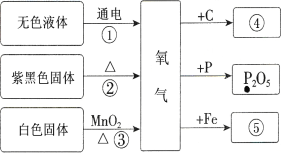
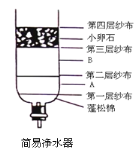
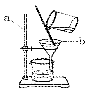
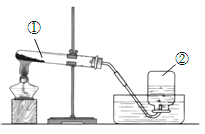
题目内容
【题目】2012年4月15日,央视《每周质量报告》报道:一些不法企业用皮革废料熬制的工业明胶生产药用胶囊.在熬制过程中添加重铬酸钾(K2Cr2O7),导致生产的药用胶囊重金属铬超标。根据化学式计算:
(1)该物质由 种元素组成。(2分)
(2)计算钾、铬、氧三种元素的质量比(要求最简整比)(2分)
(3)计算铬元素的质量分数(结果保留到0.1%)。(2分)
(4)计算29.4g该物质中含有钾元素的质量(3分)
【答案】(1)三(2)钾元素铬元素氧元素质量比=39:52:56 (3)铬元素质量分数:35.4% (4)7.8g
【解析】
试题分析:(1)重铬酸钾(K2Cr2O7)由钾、铬、氧三种元素组成;(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得重铬酸钾中钾、铬、氧元素的质量比为:(39×2):(52×2):(16×7)=39:52:56;(3)根据物质中某元素的质量分数=![]() ×100%,可得重铬酸钾中铬元素的质量分数为:
×100%,可得重铬酸钾中铬元素的质量分数为:![]() ×100%=35.4%;(4)29.4g重铬酸钾中含有钾元素的质量为29.4g×(
×100%=35.4%;(4)29.4g重铬酸钾中含有钾元素的质量为29.4g×(![]() ×100%)=7.8g.
×100%)=7.8g.

练习册系列答案
相关题目