题目内容
【题目】“碳汇”是指从空气中清除和吸收二氧化碳的过程与机制。科学家设想出碳捕捉技术,利用如下图所示的太阳能加热器完成CO2的“捕捉”和“释放”,实现碳循环。则回答:
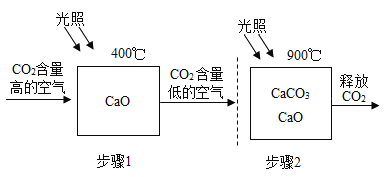
(1)碳捕捉的步骤1的化学方程式为___。步骤2中分离出的CO2可制成干冰,则干冰常用于____;
(2)上述中可循环利用的物质俗名为____,请说明这种碳捕捉设想的优点有哪些(至少一点)____。
【答案】CaO+CO2![]() CaCO3 可用于人工降雨或食品冷藏保鲜等 生石灰 原料易得且可循环利用,充分利用太阳能等
CaCO3 可用于人工降雨或食品冷藏保鲜等 生石灰 原料易得且可循环利用,充分利用太阳能等
【解析】
(1)氧化钙和二氧化碳在高温下生成碳酸钙,反应的化学方程式为:CaO+CO2![]() CaCO3;因为干冰升华易吸收大量的热,所以干冰常用作制冷剂,常用于人工降雨等;
CaCO3;因为干冰升华易吸收大量的热,所以干冰常用作制冷剂,常用于人工降雨等;
(2)氧化钙和二氧化碳在高温下生成碳酸钙,碳酸钙高温生成了氧化钙和二氧化碳,所以氧化钙可以循环使用,氧化钙俗称生石灰;上述设想的优点是原料易得并可循环利用,利用新的能源--太阳能。

练习册系列答案
相关题目