题目内容
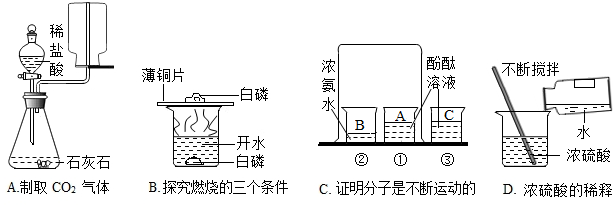
为测定某石灰石样品中碳酸钙的含量,取12克于烧杯中再向其中加入稀盐酸48克,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为55.6克.求:
(1)生成CO2的质量 克.
(2)求石灰石样品中碳酸钙的质量分数(精确到0.1%,写出计算过程).
(1)生成CO2的质量
(2)求石灰石样品中碳酸钙的质量分数(精确到0.1%,写出计算过程).
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据差量法可以计算生成二氧化碳的质量;
(2)根据反应生成二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算石灰石样品中碳酸钙的质量分数.
(2)根据反应生成二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算石灰石样品中碳酸钙的质量分数.
解答:解:(1)反应生成二氧化碳的质量为:12g+48g-55.6g=4.4g.
故填:4.4g.
(2)解:设石灰石样品中碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
=
x=10g,
石灰石样品中碳酸钙的质量分数为:
×100%=83.3%;
答:石灰石样品中碳酸钙的质量分数为83.3%.
故填:4.4g.
(2)解:设石灰石样品中碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
| 100 |
| x |
| 44 |
| 4.4g |
x=10g,
石灰石样品中碳酸钙的质量分数为:
| 10g |
| 12g |
答:石灰石样品中碳酸钙的质量分数为83.3%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,比较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 碳和部分碳的化合物间转化关系如图所示.
碳和部分碳的化合物间转化关系如图所示.