题目内容
【题目】工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如图1(部分产物略去):
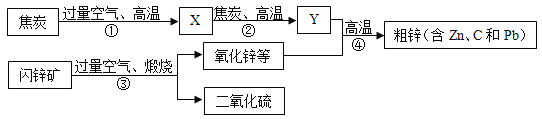
(1)X的化学式是________,如图中用过量空气的目的是____________。
(2)①~④中属于化合反应的是________
(3)Zn________(填“能”或“不能”)与![]() 溶液反应。
溶液反应。
(4)写出反应②③的化学方程式___________________。
(5)结合下表数据设计:从粗锌中分离出纯锌的方案是________℃________。
物质 | Zn | Pb | C |
沸点℃ | 907 | 1749 | 4827 |
【答案】CO2 使焦炭完全反应生成二氧化碳 ①② 能 CO2+C![]() 2CO 和2ZnS+3O2
2CO 和2ZnS+3O2 ![]() 2ZnO+2SO2 907℃~1749℃ 将收集到的锌蒸气冷却就能得到纯净的固态锌
2ZnO+2SO2 907℃~1749℃ 将收集到的锌蒸气冷却就能得到纯净的固态锌
【解析】
(1)焦炭与空气中的氧气反应生成二氧化碳,所以X为二氧化碳,其化学式为CO2,故填CO2;
使用过量的氧气可以使焦炭完全反应生成二氧化碳,故填使焦炭完全反应生成二氧化碳。
(2)反应①是碳与氧气在点燃的条件下反应生成二氧化碳,属于化合反应,反应②是二氧化碳与碳在高温的条件下反应生成一氧化碳,属于化合反应,反应③是硫化锌与氧气在高温的条件下反应生成氧化锌和二氧化硫,不属于化合反应,反应④是氧化锌与一氧化碳在给我的条件下反应生成锌和二氧化碳,不属于化合反应,所以属于化合反应的是反应①②,故填①②。
(3)由金属活动性顺序可知,锌的活动性比铅强,所以锌能与氯化铅反应生成氯化锌和铅,故填能。
(4)反应②是二氧化碳与碳在高温的条件下反应生成一氧化碳,反应的化学方程式为CO2+C![]() 2CO,反应③是硫化锌与氧气在高温的条件下反应生成氧化锌和二氧化硫,反应的化学方程式为2ZnS+3O2
2CO,反应③是硫化锌与氧气在高温的条件下反应生成氧化锌和二氧化硫,反应的化学方程式为2ZnS+3O2 ![]() 2ZnO+2SO2,故填CO2+C
2ZnO+2SO2,故填CO2+C![]() 2CO和2ZnS+3O2
2CO和2ZnS+3O2 ![]() 2ZnO+2SO2。
2ZnO+2SO2。
(5)由图可知,锌的沸点为907℃,铅的沸点为1749℃,均低于碳的沸点4827℃,所以将温度控制在907℃~1749℃之间,就能得到纯净的锌蒸气,故填907℃~1749℃;
将收集到的锌蒸气冷却就能得到纯净的固态锌,故填将收集到的锌蒸气冷却就能得到纯净的固态锌。

 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】请结合下图回答下列问题。
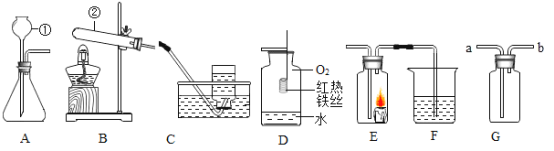
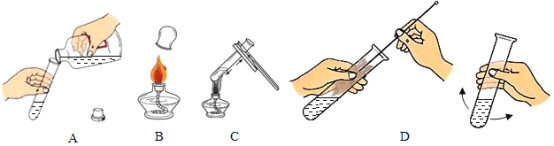
(1)请写出图中标号仪器的名称:①_________;②_________.
(2)选择B装置制氧气的文字表达式为_________, 选择C装置收集氧气的原理是_________, D中水的作用是_________。
(3)某同学连接A、E、F进行实验,若实验时E中蜡烛燃烧更旺,F 中澄清石灰水变浑浊,则仪器①中所加药品为_________, A中发生反应的文字表达式_________, F中澄清石灰水变浑浊的原因是_________。
(4)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水。制取并收集氨气,应从上图中选择_________。
(5)实验室加热一定量高锰酸钾固体制取氧气时,如图所示,表示某物质随时间变化的关系,则纵坐标表示的是_________。

a.高锰酸钾的质量 b.氧气的质量 c.二氧化锰的质量 d.试管中剩余固体物质质量
(6)带火星木条在氧气中可以复燃。那么,是不是只有纯净的氧气才能使带火星的木条复燃呢?为此,同学们开展了相关的实验探究。实验主要步骤如下:先制取一定量的氧气备用,再测得集气瓶实际容积为317 mL,然后采用某种正确的收集方法得到5瓶氧气含量不同的气体,最后用带火星的木条来检验,观察木条是否复燃,相关的数据见下表:
集气 编号 | 瓶内预装水体积/mL | 充入氧气体积/ mL | 瓶内空气体积/mL | 瓶内空气里氧气的体积分数 | 木条能不能复燃 |
1 | 120 | 120 | 197 | 50.9% | 能 |
2 | 97 | 97 | 220 | 能 | |
3 | 90 | 90 | 227 | 43.4% | 能 |
4 | 84 | 84 | 233 | 41.9% | 能 |
5 | 81 | 81 | 236 | 41.2% | 不能 |
表中空格处应填______,由该实验可得到的结论是_______。