题目内容
【题目】20g硫酸镁溶液中混有少量硫酸,往该溶液中滴加足量氢氧化钠溶液,充分反应后得到2.9g氢氧化镁沉淀。沉淀的质量变化如图所示。
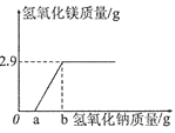
(1)求20g溶液中硫酸镁的质量分数。
【反应的化学方程式为MgSO4+2NaOH==Mg(OH)2↓+Na2SO4】
(2)氢氧化钠的质量 g时,反应不产生沉淀,其原因是 。
【答案】(1)30% (2)≦a 氢氧化钠不足,即使生成氢氧化镁也立即与硫酸反应
【解析】
试题分析:(1)往硫酸镁中混有少量硫酸混合溶液中滴加足量氢氧化钠溶液,先后发生2个反应:2NaOH+H2SO4==Na2SO4+2H2O,MgSO4+2NaOH==Mg(OH)2↓+Na2SO4,故根据方程式中物质的质量关系,可计算出硫酸镁的质量,进一步计算出20g溶液中硫酸镁的质量分数
解:设硫酸镁的质量为x
MgSO4+2NaOH==Mg(OH)2↓+Na2SO4
120 58
x 2.9g
120:58=x:2.9g
x=6g
所以20g溶液中硫酸镁的质量分数=6g/20g×100%=30%
(2)根据(1)的分析,氢氧化钠的质量≦a g时,反应不产生沉淀,其原因是:氢氧化钠不足,即使生成氢氧化镁也立即与硫酸反应

练习册系列答案
相关题目
【题目】某中学的同学自制成一种黄色的花汁,加入到不同试剂中,观察到的现象如下:
试剂 | 稀盐酸 | 食盐水 | 蒸馏水 | 草木灰水 | 石灰水 |
颜色 | 红 | 黄 | 黄 | 绿 | 绿 |
小强同学依据上表信息进行如下实验:
(1)用该花汁去检验废水的酸碱性,显绿色,则废水显 性,废水的pH 7.
(2)用该花汁测知家中花盆土壤显酸性,最好可加入上表中的 改良土壤.
