题目内容
为了测定实验室中KClO3样品的纯度,取25克该样品(杂质不参加反应)与5克二氧化锰混合,加热至不再产生气体为止,称量剩余固体的质量为20.4克.求:
(1)纯净的氯酸钾中各元素质量比;
(2)纯净的氯酸钾中氧元素的质量分数;
(3)完全反应后生成氧气的质量;
(4)该样品中氯酸钾的质量分数.
【答案】分析:(1)根据氯酸钾的化学式,求出纯净的氯酸钾中各元素质量比;
(2)根据氯酸钾的化学式,求出纯净的氯酸钾中氧元素的质量分数;
(3)根据氯酸钾分解的反应的方程式及质量守恒定求出生成的氧气的质量;
(4)根据氯酸钾分解的反应的方程式,由氧气的质量求出氯酸钾的质量,再求出样品中氯酸钾的质量分数.
解答:解:(1)纯净的氯酸钾中钾、氯、氧元素的质量比为:39:35.5:(16×3)=39:35.5:48=78:71:96;
(2)氯酸钾中氧元素的质量分数为: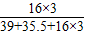 ×100%=39.2%;
×100%=39.2%;
(3)由质量守恒定律可知,生成的氧气的质量为:25g+5g-2.04g=9.6g;
(4)设该样品中氯酸钾的质量为X
2KClO3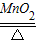 2KCl+3O2↑
2KCl+3O2↑
245 96
x 9.6g
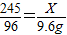 解得:X=24.5g
解得:X=24.5g
样品中氯酸钾的质量分数为: ×100%=98%
×100%=98%
答:(1)纯净的氯酸钾中各元素质量比是78:71:96;(2)纯净的氯酸钾中氧元素的质量分数是39.2%;
(3)完全反应后生成氧气的质量是9.6克;(4)该样品中氯酸钾的质量分数是98%.
点评:本题主要考查学生利用化学方程式和质量分数公式进行计算的能力.利用质量守恒定律,计算出生成气体的质量,再结合化学方程式,就可以解决要求的问题.
(2)根据氯酸钾的化学式,求出纯净的氯酸钾中氧元素的质量分数;
(3)根据氯酸钾分解的反应的方程式及质量守恒定求出生成的氧气的质量;
(4)根据氯酸钾分解的反应的方程式,由氧气的质量求出氯酸钾的质量,再求出样品中氯酸钾的质量分数.
解答:解:(1)纯净的氯酸钾中钾、氯、氧元素的质量比为:39:35.5:(16×3)=39:35.5:48=78:71:96;
(2)氯酸钾中氧元素的质量分数为:
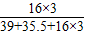 ×100%=39.2%;
×100%=39.2%;(3)由质量守恒定律可知,生成的氧气的质量为:25g+5g-2.04g=9.6g;
(4)设该样品中氯酸钾的质量为X
2KClO3
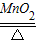 2KCl+3O2↑
2KCl+3O2↑245 96
x 9.6g
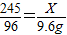 解得:X=24.5g
解得:X=24.5g样品中氯酸钾的质量分数为:
 ×100%=98%
×100%=98%答:(1)纯净的氯酸钾中各元素质量比是78:71:96;(2)纯净的氯酸钾中氧元素的质量分数是39.2%;
(3)完全反应后生成氧气的质量是9.6克;(4)该样品中氯酸钾的质量分数是98%.
点评:本题主要考查学生利用化学方程式和质量分数公式进行计算的能力.利用质量守恒定律,计算出生成气体的质量,再结合化学方程式,就可以解决要求的问题.

练习册系列答案
相关题目
 某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行,实验步骤如下:
某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行,实验步骤如下: