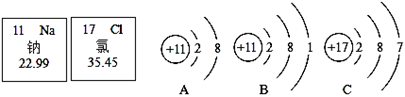题目内容
元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究: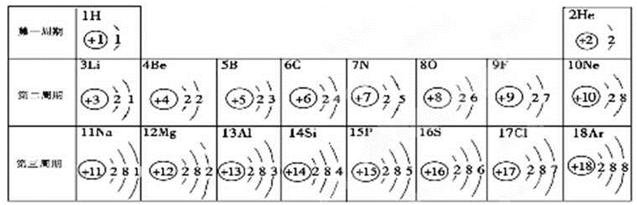
(1)第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的______________数关系密切;
(3)在同一纵行中,各元素的原子结构呈现的规律有________________ (任写一点);
(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。请分析第三周期从11~17号元素原子半径变化规律是 _______________________。
(1)非金属;得;(2)最外层电子;(3)电子层数递增 或最外层电子数相等 或从上到下核电荷数增大等;(4)逐渐减小。
解析试题分析:(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,可知:第16号元素属于非金属元素;故答案为:非金属;得;
(2)根据元素的化学性质与原子核外的最外层电子数有密切关系:电子数少于四个的一般容易失去电子形成阳离子,电子数少于八个而多于或等于四个的一般容易得到电子形成阴离子,电子数为八个的化学性质一般稳定,不容易发生化学变化;进行解答;故答案为:最外层电子;
(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点可知:电子层数递增,或最外层电子数相等,或从上到下核电荷数增大等;故答案为:电子层数递增 或最外层电子数相等 或从上到下核电荷数增大等;
(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.所以从11~17号元素原子半径变化规律是;逐渐减小;故答案为:逐渐减小。
考点:元素周期表的特点及其应用;原子的定义与构成;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图。

 阅读快车系列答案
阅读快车系列答案元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表部分内容),回答有关问题:
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于硅元素的一条信息: 。
(2)第6号元素与地壳中含量最多的元素可组成一种物质是 (填名称)。这两种元素的原子还可以形成一种阴离子,该离子符号是 。
(3)第3周期里金属活动最强的金属元素与第17号元素组成的化合物的化学式是 。构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)查得资料:在元素周期表中,同一纵行(族)的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是 (填标号)。.
a、Li和Na b、C和N c、B和Mg d、Ne和Ar
(5)第9号元素的气体单质(F2)常温下与水发生反应,生成氢氟酸(HF)和另一种无色气体单质,该反应的化学方程式为 。
 N2↑+2H2O
N2↑+2H2O