题目内容
我们的日常生活离不开金属.下面是某学习小组的同学对Mg、Fe、Cu、Hg、Ag 五种金属相关知识的归纳复习,请你回答.
(1)从物理性质上看,每种金属都有自己的特性.你认为Hg与其他四种金属的不同之处是______.
(2)性质决定用途,生活中常用铜来做导线,这是利用了铜的______性.
(3)从化学性质上看,与盐酸反应最剧烈的是______,在这五种金属中,有一种金属的盐溶液能与其它四种金属发生反应,该金属是______,写出其中一个的化学反应方程式______.
(4)炼铁厂通常以焦炭(主要成分是C)、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下: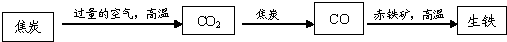
写出CO与赤铁矿反应的化学方程式______.取少量炼出的生铁粉末放入烧杯中,加入过量稀盐酸,可观察到的现象是______.
解:(1)金属汞常温下为液体而大多数金属为固体;
(2)铜制作导线是利用了铜的导电性;
(3)根据金属活动性顺序表知道五种金属中镁最活泼,所以与盐酸反应最剧烈的是镁;五种金属中银最不活泼,所以能与四种金属发生反应的金属盐溶液是银的盐溶液;
(4)一氧化碳具有还的性,能将氧化铁中的铁还原出来,铁与盐酸反应产生氢气.
故答案为:(1)常温下,Hg是液体,而其余的为固体;(2)导电性;(3)Mg(或镁);Ag(或银);
Cu+2AgNO3═Cu(NO3)2+2Ag (4)3CO+Fe2O3 2Fe+3CO2;有气泡产生.
2Fe+3CO2;有气泡产生.
分析:依据金属的物理性质可知常温下汞和大多数金属的状态不同;金属活动性顺序中,金属活动性越强,与酸反应越剧烈;位于前面的金属能把位于后面的金属从它们的化合物溶液中置换出来.
点评:本题综合考查金属的物理性质和化学性质,特别是金属活动性顺序的具体应用.
(2)铜制作导线是利用了铜的导电性;
(3)根据金属活动性顺序表知道五种金属中镁最活泼,所以与盐酸反应最剧烈的是镁;五种金属中银最不活泼,所以能与四种金属发生反应的金属盐溶液是银的盐溶液;
(4)一氧化碳具有还的性,能将氧化铁中的铁还原出来,铁与盐酸反应产生氢气.
故答案为:(1)常温下,Hg是液体,而其余的为固体;(2)导电性;(3)Mg(或镁);Ag(或银);
Cu+2AgNO3═Cu(NO3)2+2Ag (4)3CO+Fe2O3
 2Fe+3CO2;有气泡产生.
2Fe+3CO2;有气泡产生.分析:依据金属的物理性质可知常温下汞和大多数金属的状态不同;金属活动性顺序中,金属活动性越强,与酸反应越剧烈;位于前面的金属能把位于后面的金属从它们的化合物溶液中置换出来.
点评:本题综合考查金属的物理性质和化学性质,特别是金属活动性顺序的具体应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目