题目内容
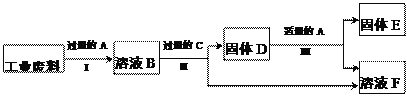
【题目】A、B、C是初中化学常见的物质,都含有同一种元素,它们之间的转化关系如下(“→” 表示一步化学反应)
(1)如果A、B组成元素相同,B含量过多导致温室效应加剧,写出一个符合B→C的化学方程式:__________________;
(2)如果B为密度最小的气体,则A、C的化学式可以是_____________
①HCl、H2O ②H2SO4、NaOH ③H2O2、Ca(OH)2
(3)如果A、B、C是不同类别的化合物,B是改良酸性土壤的碱,B→C发生中和反应,则A的化学式可能是__________。
【答案】 Ca(OH)2+CO2![]() CaCO3↓+H2O(或2NaOH+CO2
CaCO3↓+H2O(或2NaOH+CO2![]() Na2CO3+H2O或其它正确答案) ① H2O或CaO
Na2CO3+H2O或其它正确答案) ① H2O或CaO
【解析】(1)B物质可以导致温室效应,故B物质是二氧化碳,AB的组成元素相同,故A是一氧化碳,,则C是碳酸盐,二氧化碳与氢氧化钙反应生成碳酸钙和水,反应方程式为Ca(OH)2+CO2![]() CaCO3↓+H2O;
CaCO3↓+H2O;
(2)密度最小的气体是氢气,如A为HCl,则HCl与金属反应可以生成氢气,氢气可以与氧气反应生成水,故①正确;②中的硫酸可以生成氢气,但是氢气不能生成氢氧化钠,故错误;③在过氧化氢不能生成氢气,错误。故选①
(3)B是改良酸性土壤的碱,则B是氢氧化钙,BC可以发生中和反应,故C是酸,ABC是不同类别的物质,且A能生成氢氧化钙,故A是氧化钙或水,化学式为H2O或CaO

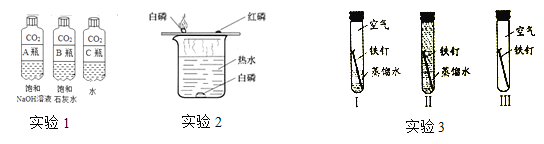
【题目】课堂上,老师取20g蔗糖放入不烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强_____.
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动.
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀.
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体.
Ⅱ.SO2是一种具有刺激性气味的气体,能与Ca(OH)2溶液反应生成白色沉淀.
Ⅲ.SO2能使品红溶液褪色,而CO2不能.
【实验探究】
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:
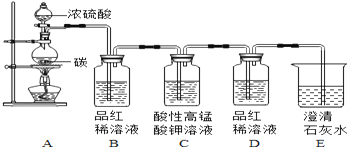
【事实与结论】
(1)请将能得出对应结论的实验现象填入表中。
验证气体 | 实验现象 | 实验结论 |
SO2 | __________________ | 有SO2产生 |
CO2 | ____________________ | 有CO2产生 |
(2)二氧化硫与澄清石灰水反应的化学方程式是_____________。
(3)浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立。
【反思与交流】
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是_________。
(2)若B、E中试剂交换,______(填“能”或“不能”)得出有CO2产生的结论,理由是_______________________。
(3)C中酸性高锰酸钾溶液的作用是______________.
【题目】某学习小组在探究碳酸钠的化学性质时,做了下面所示三个实验.
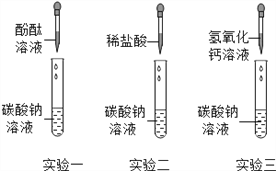
(1)实验一:探究碳酸钠溶液的酸碱性。观察到试管中溶液变为红色,可得出结论是 ________________________
实验二:探究碳酸钠与稀盐酸的反应.试管中产生大量气泡,该反应化学方程式为 _______________________。
实验三:探究碳酸钠与氢氧化钙溶液的反应.试管中产生白色沉淀,该白色沉淀为 ________
(2)小组同学将实验三试管内液体进行过滤,对滤液中溶质成分展开了探究.
【提出问题】滤液中溶质成分是什么?
【猜想】
猜想一:滤液中溶质是氢氧化钠;
猜想二:滤液中溶质是氢氧化钠、氢氧化钙和碳酸钠;
猜想三:滤液中溶质是氢氧化钠、氢氧化钙;
猜想四:滤液中溶质是______________
【讨论】大家一致认为猜想二不成立,理由是 ___________________________________。
【实验验证】
小组同学通过以下实验验证了猜想三成立,请你完成实验报告.
实验步骤 | 实验现象 | 实验结论 |
取实验三少量滤液与试管中,通入二氧化碳气体 | _______________ | 猜想三成立 |
(3)实验结束,同学对废液进行处理,将实验一、实验二溶液倒入同一洁净烧杯,得到无色溶液,则实验二试管中溶液含有溶质为 ________________。
【题目】蚊虫叮咬分泌出乙酸刺激皮肤,某兴趣小组对乙酸进行如下的探究:
【查阅资料】:甲酸,又称乙酸,具有酸的通性,甲酸的熔点是8.6℃,受热能分解生成两种物质。
实验探究一:验证甲酸的酸性,完成实验记录。
操作 | 实验现象 | 原理或解释 | |
取甲酸溶于水 | 滴加紫色石蕊 | 溶液变成红色 | 溶液中含有_____填离子符号) |
加适量的锌粒 | 观察到有气泡产生 | 锌粒与甲酸生成了Zn(HCOO)2和一种气体,写出该反应的方程式__________ | |
加氢氧化镁粉末 | 观察到_____ | 甲酸可以与碱反应 |
实验探究二:探究甲酸分解的产物。
【提出猜想】:实验小组对甲酸的分解产物提出了猜想:
猜想1:H2和CO2;猜想二:CO和H2O。
同学们提出以上猜想的依据是:__________________________
【设计实验】根据资料,小组同学从下图装置中选择装置图_______(填“甲”或‘乙’)对甲酸进行加热。
【交流与拓展】资料表明,甲酸的分解产物不同,猜想一与猜想二均成立。据此小林对甲酸的分解产物又提出新猜想-----猜想3:H2O和CO2;猜想四:CO与H2,同学们讨论后认为无需进行实验就知道猜想三和猜想四是错误的,理由是:_____________