题目内容
(2008?达州)将一根锃亮的铁丝放入蓝色的硫酸铜溶液中,过一会,发现铁丝表面出现了红色物质.
(1)写出发生反应的化学方程式:
(2)由此判断金属的活动性:Fe
(3)在化学反应中,元素化合价升高的反应物是还原剂,元素化合价降低的反应物是氧化剂.请你指出上述反应中,氧化剂是
(1)写出发生反应的化学方程式:
Fe十CuSO4═FeSO4十Cu
Fe十CuSO4═FeSO4十Cu
.(2)由此判断金属的活动性:Fe
>
>
Cu(选填“>”、“=”或“<”)(3)在化学反应中,元素化合价升高的反应物是还原剂,元素化合价降低的反应物是氧化剂.请你指出上述反应中,氧化剂是
CuSO4(或硫酸铜)
CuSO4(或硫酸铜)
.分析:在金属活动性顺序中,铁排在铜的前面,能把铜从它的盐溶液中置换出来,生成红色的铜和浅绿色硫酸亚铁溶液.根据化合价变化判断氧化剂和还原剂时,元素化合价升高的反应物是还原剂,元素化合价降低的反应物是氧化剂,因为单质的化合价为零,金属在化合物中一般显正价,因此,反应物为单质的金属一般是还原剂,被置换的金属元素一般是氧化剂.
解答:解:(1)铁的活动性比铜强,能把铜从它的盐溶液中置换出来,生成红色的铜和浅绿色硫酸亚铁溶液,化学方程式为:Fe十CuSO4═FeSO4十Cu
(2)铁能置换出铜,说明铁比铜活泼,答案为:>
(3)在铁与硫酸铜反应中,硫酸铜中的铜为+2价,变成单质铜后为0价,化合价降低,所以硫酸铜是氧化剂.答案:硫酸铜
(2)铁能置换出铜,说明铁比铜活泼,答案为:>
(3)在铁与硫酸铜反应中,硫酸铜中的铜为+2价,变成单质铜后为0价,化合价降低,所以硫酸铜是氧化剂.答案:硫酸铜
点评:本题主要考查铁与硫酸铜的反应方程式及元素化合价的变化,并根据化合价的改变判断还原剂和氧化剂.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
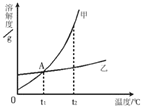 (2008?达州)下图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.
(2008?达州)下图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.