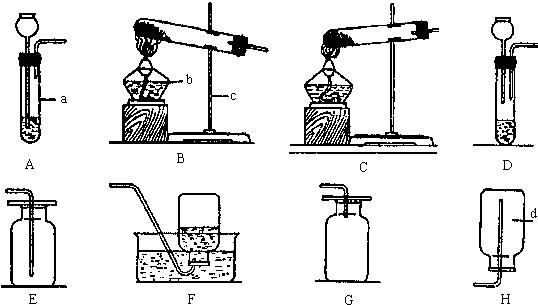
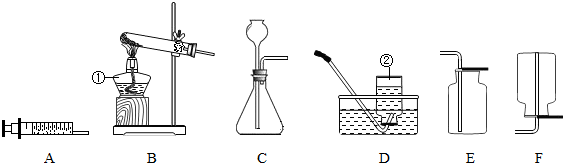
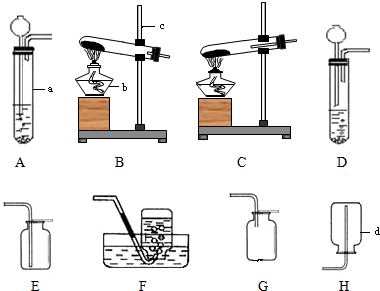
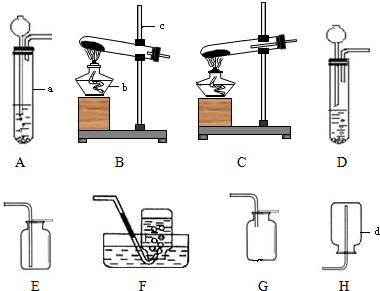
题目内容
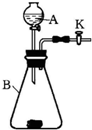 在学习了实验室制取CO2之后,联想到该装置也用于在实验室中用H2O2制取氧气.
在学习了实验室制取CO2之后,联想到该装置也用于在实验室中用H2O2制取氧气.(1)写出仪器的名称:B
(2)实验室用大理石和稀盐酸制取CO2的化学方程式为
(3)实验室用51g 2%的H2O2溶液和一定量的MnO2制取氧气,其化学方程式为
①H2O2的摩尔质量是
②51g2%的H2O2溶液中,含有H2O2
③试计算完全反应后产生氧气的物质的量.
分析:(1)直接写出仪器的名称
(2)根据大理石的主要成分为碳酸钙,和稀盐酸反应生成了二氧化碳
(3)根据实验室中过氧化氢来制取氧气的原理可以写出该反应的化学方程式,根据摩尔质量的定义然后利用化学方程式解答
(2)根据大理石的主要成分为碳酸钙,和稀盐酸反应生成了二氧化碳
(3)根据实验室中过氧化氢来制取氧气的原理可以写出该反应的化学方程式,根据摩尔质量的定义然后利用化学方程式解答
解答:解:(1)直接写出仪器的名称为:锥形瓶
(2)实验室中制取二氧化碳的反应原理为:CaCO3+2HCl═CaCl2+H2O+CO2↑
(3)可以直接写出过氧化氢分解的化学方程式:2H2O2
2H2O+O2↑;
①过氧化氢的摩尔质量为:1×2+16×2=34g/mol,一个过氧化氢分子中含有两个氧原子,1mol过氧化氢中含有的氧原子个数为2×6.02×1023
②过氧化氢的质量为:51g×2%=1.02g;n=
=1.
=0.03mol
③根据过氧化氢的摩尔质量结合化学方程式可以求出生成氧气的质量
故答案为:(1)锥形瓶(2)CaCO3+2HCl→CaCl2+H2O+CO2↑.
(3)2H2O2
2H2O+O2↑;
①34,2×6.02×1023;
②1.02,0.03
③设完全反应后产生氧气的物质的量x mol
2H2O2
2H2O+O2↑
2 1
0.03 x
=
x=0.015mol
(2)实验室中制取二氧化碳的反应原理为:CaCO3+2HCl═CaCl2+H2O+CO2↑
(3)可以直接写出过氧化氢分解的化学方程式:2H2O2
| ||
①过氧化氢的摩尔质量为:1×2+16×2=34g/mol,一个过氧化氢分子中含有两个氧原子,1mol过氧化氢中含有的氧原子个数为2×6.02×1023
②过氧化氢的质量为:51g×2%=1.02g;n=
| m |
| M |
| 1.02g |
| 18g/mol |
③根据过氧化氢的摩尔质量结合化学方程式可以求出生成氧气的质量
故答案为:(1)锥形瓶(2)CaCO3+2HCl→CaCl2+H2O+CO2↑.
(3)2H2O2
| ||
①34,2×6.02×1023;
②1.02,0.03
③设完全反应后产生氧气的物质的量x mol
2H2O2
| ||
2 1
0.03 x
| 2 |
| 0.03 |
| 1 |
| x |
x=0.015mol
点评:熟练掌握实验室中制取二氧化碳和氧气的反应原理,能够求出物质的量,并根据物质的物质的量来根据化学方程式进行计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目