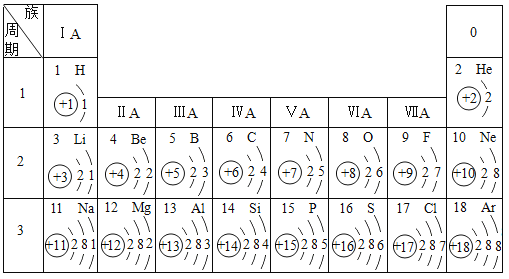
题目内容
【题目】据有关资料介绍,制取氧气有多种方法。其中氧化铜与氯酸钾混合加热,也能很快产生氧气,现将2.5g氧化铜与24.5g氯酸钾的混合物充分加热,残余固体经冷却、称量后质量为17.4g。然后将固体溶于65.1g水中,充分搅拌,过滤后得到滤液和黑色的滤渣。滤渣又经过洗涤、烘干、称量,质量为2.5g。(不考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起____作用。
(2)生成的氧气为____g。
(3)求所得的滤液溶质的质量分数___?(此题需用化学方程式计算,结果保留一位小数)
【答案】催化 9.6 18.6%
【解析】
解:(1)氧化铜在反应前后的质量没有改变,可以判断氧化铜是该反应的催化剂,起催化作用;
(2)生成氧气的质量为:2.5g+24.5g-17.4g=9.6g;
(3)氯酸钾在加热的条件下生成氯化钾和氧气,氧化铜难溶于水,氯化钾易溶于水,所以
所得滤液中溶质是氯化钾,氯化钾的质量为:17.4g-2.5g=14.9g,所以质量分数为:![]() ×100%=18.6%。
×100%=18.6%。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】化学小组用排水法收集了呼出气体,通过(实验1)比较吸入空气和呼出气体的成分差异。
(实验1)
序号 | 实验目的 | 实验操作 | 实验现象 |
① | 比较空气和呼出气体中二氧化碳的含量 | 向呼出气体中倒入少量澄清石灰水,振荡 | _____ |
② | 比较空气和呼出气体中氧气的含量 | 分别将燃着的木条伸入空气和呼出气体中 | 空气中的木条无明显变化,呼出气体中的木条熄灭 |
③ | _____ | 取两块干燥玻璃片,对着其中一块哈气 | 哈气的玻璃片上出现无色液滴,另一块无明显变化 |
(1)实验①的现象为_____,证明呼吸过程中发生了_____(“物理”或“化学”)变化。
(2)实验③的目的是_____。
(3)小明指出实验①不能比较空气和呼出气体中CO2的含量,还需补充的实验操作为_____。小芳对②中燃着木条熄灭的原因提出猜想,并设计(实验2)进行验证。
(猜想与假设)
猜想1:木条熄灭是因为呼出气体比吸入空气中CO2的含量高。
猜想2:木条熄灭是因为呼出气体比吸入空气中O2的含量低。
(实验2)
序号 | ① | ② | ③ | ④ |
实验操作 |
空气 |
O2和CO2体积比 |
O2和N2体积比 |
O2和N2体积比 |
实验现象 | 燃着的木条无明显变化 | 燃着的木条无明显变化 | 燃着的木条熄灭 | 燃着的木条熄灭 |
(4)由实验①和②可得出猜想1_____(填“成立”或“不成立”)。
(5)(实验2)中,能证明猜想2成立的实验序号是_____。
(实验反思)
(6)根据以上实验,下列说法正确的是_____(填字母序号)。
A 吸入空气和呼出气体中O2和CO2的含量不同
B 将燃着木条伸入呼出气体中,木条熄灭,说明呼出气体中没有O2
C (实验1)的②中,燃着木条熄灭的原因还可能与水蒸气含量增多有关
D 若把燃着木条伸入体积比为1:1的O2和CO2混合气体中,会观察到无明显变化