题目内容
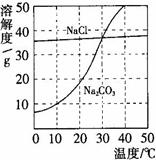
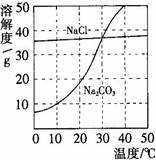
(5分)下图为氯化钠、碳酸钠在水中的溶解度曲线。请回答下列问题:
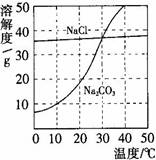
1.30℃时,氯化钠的溶解度 碳酸钠的溶解度(填写“>”、“<”或“=”);
2.10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是 溶液;
3.将30℃时相同质量的两种物质的饱和溶液,分别降温到10℃,晶体析出较多的是 。
4.要使接近饱和的碳酸钠溶液变为饱和溶液,可采取的一种措施是_____________。
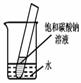
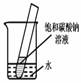
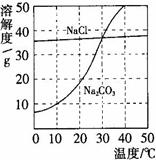
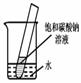
5.如下图所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是________(填字母序号)。
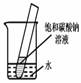
A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸
【答案】
1.=
2.NaCl
3.Na2CO3
4.降温(或加入碳酸钠固体)
5.C (各1分)
【解析】(1)30℃时,两曲线相交,说明二者的溶解度相等,(2)10℃时,NaCl的溶解度比碳酸钠的溶解度大,所以饱和的氯化钠溶液的溶质质量分数比较大(3)碳酸钠的溶解度随温度的变化大,所以晶体析出较多的是Na2CO3,(4)碳酸钠的溶解度随温度的降低而减小,所以要变成饱和溶液,可以采取降温或加入碳酸钠固体,(5)碳酸钠的溶解度随温度的降低而减小,有Na2CO3晶体析,就说明水温在降低,硝酸铵溶于水可以使温度降低,故选C

练习册系列答案
相关题目
 。
。