题目内容
Fe2O3中铁元素与氧元素的质量比为分析:计算Fe2O3中铁元素与氧元素的质量比的依据是所含元素的质量比,等于微观上每个分子(即化学式)中各种原子的个数与其原子量的乘积之比;
根据化学反应方程式Fe2O3+3CO
2Fe+3CO2↑求得三氧化二铁的质量,然后由纯净物的质量=不纯物的质量×纯净物的质量分数求得所需赤铁矿的质量.
根据化学反应方程式Fe2O3+3CO
| ||
解答:解:Fe2O3中铁元素与氧元素的质量比=
=
,即Fe2O3中铁元素与氧元素的质量比是7:3;
设要生产525吨铁,至少需含Fe2O375%的赤铁矿石x吨.则
Fe2O3+3CO
2Fe+3CO2↑
160 112
75%x吨 525吨
所以
=
,
解得,x=1000吨.
故本题的答案是:7:3;1000.
| 2×56 |
| 3×16 |
| 7 |
| 3 |
设要生产525吨铁,至少需含Fe2O375%的赤铁矿石x吨.则
Fe2O3+3CO
| ||
160 112
75%x吨 525吨
所以
| 160 |
| 75%x |
| 112 |
| 525 |
解得,x=1000吨.
故本题的答案是:7:3;1000.
点评:化学方程式中所表示的反应物和生成物都是指纯净物,不纯物质不能代入方程式进行计算.遇到不纯物质时,需要将不纯物质换算成纯净物质的量,才能代入方程式,按质量比进行计算.计算关系为:纯净物的质量=不纯物的质量×纯净物的质量分数.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
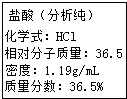 实验室一分析纯盐酸的标签如图所示;某钢铁厂为了 测定赤铁矿中Fe2O3的含量,将20g赤铁矿(杂质既不与酸 反应也不溶于水)加到219g10%的稀盐酸中,恰好完全反应 生成氯化铁和水.求:
实验室一分析纯盐酸的标签如图所示;某钢铁厂为了 测定赤铁矿中Fe2O3的含量,将20g赤铁矿(杂质既不与酸 反应也不溶于水)加到219g10%的稀盐酸中,恰好完全反应 生成氯化铁和水.求: