题目内容
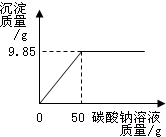
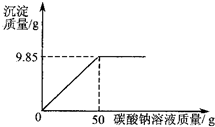 小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯化钠组成的产品中氯化钠的质量分数.取16.25g固体样品,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系.
小红同学在某化工厂进行社会实践,技术员与小红一起分析由氯化钡和氯化钠组成的产品中氯化钠的质量分数.取16.25g固体样品,全部溶于143.6mL水中,向所得到的混合溶液中逐滴加入溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系.
当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
解:根据曲线可知,当加入碳酸钠溶液50g时,恰好完全反应;
设样品中BaCl2的质量为x,生成NaCl的质量为y.
BaCl2+Na2CO3═BaCO3↓+2NaCl
208 106 117
x 50g×10.6% y
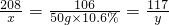
解得:x=10.4g,y=5.85g;
所以原固体中氯化钠的质量是16.25g-10.4g=5.85g
水的密度为1g/cm3,则143.6mL水的质量为143.6mL×1g/cm3=143.6g;
当氯化钡与碳酸钠恰好完全反应时.过滤后所得溶液的质量为:16.25g+143.6g+50g-9.85g=200g;
则溶液中溶质的质量分数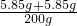 l00%=5.85%
l00%=5.85%
答:当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是5.85%.
分析:根据图象可知:曲线的折点所对应的碳酸钠溶液的质量即恰好完全反应时所消耗的质量;
根据反应的化学方程式,利用恰好完全反应时消耗碳酸钠的质量或生成沉淀的质量,计算与碳酸钠发生反应的氯化钡的质量,恰好完全反应后过滤,所得滤液为氯化钠溶液,溶质氯化钠的质量为产品中氯化钠与反应生成氯化钠质量和,滤液的质量可利用质量守恒定律进行计算;由反应计算出生成氯化钠的质量后,利用溶质质量分数计算公式求出所得滤液中溶质氯化钠的质量分数.
点评:在对反应图象中曲线进行分析时,曲线的折点的意味着曲线所表示的反应在此时恰好完全反应.
设样品中BaCl2的质量为x,生成NaCl的质量为y.
BaCl2+Na2CO3═BaCO3↓+2NaCl
208 106 117
x 50g×10.6% y
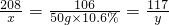
解得:x=10.4g,y=5.85g;
所以原固体中氯化钠的质量是16.25g-10.4g=5.85g
水的密度为1g/cm3,则143.6mL水的质量为143.6mL×1g/cm3=143.6g;
当氯化钡与碳酸钠恰好完全反应时.过滤后所得溶液的质量为:16.25g+143.6g+50g-9.85g=200g;
则溶液中溶质的质量分数
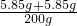 l00%=5.85%
l00%=5.85%答:当氯化钡与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是5.85%.
分析:根据图象可知:曲线的折点所对应的碳酸钠溶液的质量即恰好完全反应时所消耗的质量;
根据反应的化学方程式,利用恰好完全反应时消耗碳酸钠的质量或生成沉淀的质量,计算与碳酸钠发生反应的氯化钡的质量,恰好完全反应后过滤,所得滤液为氯化钠溶液,溶质氯化钠的质量为产品中氯化钠与反应生成氯化钠质量和,滤液的质量可利用质量守恒定律进行计算;由反应计算出生成氯化钠的质量后,利用溶质质量分数计算公式求出所得滤液中溶质氯化钠的质量分数.
点评:在对反应图象中曲线进行分析时,曲线的折点的意味着曲线所表示的反应在此时恰好完全反应.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目