题目内容
【题目】为测定某盐酸的质量分数:往20g40%的氢氧化钠溶液的烧杯中逐滴加入该盐酸,加入盐酸的质量与烧杯中溶液pH的变化关系如图所示。
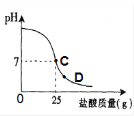
①所用氢氧化钠溶液中溶质的质量为 (8) g;
②当滴加盐酸到图像中D点时,烧杯中溶液的溶质是 (9) (填化学式);
③计算该盐酸的质量分数是多少?(根据化学方程式列式计算)(10)
【答案】(8)8.0g; (9) NaCl和HCl; (10) 29.2% 。
【解析】
试题分析:①所用氢氧化钠溶液中溶质的质量为20g×40%=8g;
②当滴加盐酸到图像中D点时,在D点时盐酸过量,故烧杯中溶液的溶质是NaCl和HCl;
③n(NaOH)=m/M =8.0g/40g/mol =0.2mol
设盐酸中含溶质HCl x mol
NaOH + HCl→ NaCl + H2O
1 1 1 1
0.2mol x mol
1/0.2 = 1/ x
X =0.2 mol
m(HCl)=n * M =0.2mol×36.5g/mol
=7.3g
C%(HCl)=7.3/25 ×100% =29.2%
答:该盐酸的实际质量分数是29.2% 。

练习册系列答案
相关题目
【题目】有一种石灰石样品,其中含有的杂质是二氧化硅(它是一种不溶于水,也不与盐酸反应,耐高温的固体物质),某同学想测定该样品的纯度,他取用2 g这种石灰石样品,把20 g稀盐酸分四次加入,充分反应后剩余固体的质量如下表所示:
稀盐酸的质量 | 剩余固体的质量 |
第一次加入5 g | 1.315 g |
第二次加入5 g | 0.63 g |
第三次加入5 g | 0.3 g |
第四次加入5 g | 0.3 g |
(1)2 g石灰石样品中的杂质质量是 g;
(2)石灰石样品的纯度为 ;
(3)100 kg这种纯度的石灰石充分煅烧后,可得到固体多少千克?