题目内容
【题目】人类一直在探索宇宙的奥秘。月球的月壳中主要含有:U(铀)、Th(钍)、K、0、Si、Mg、Fe、Ti(钛)、Ca、Al、H、He-3等元素,未来可能会成为人类的宝贵资源。根据图示回答下列问题:
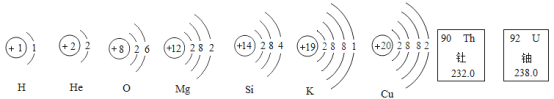
(1)铀元素的原子序数为_________________;钍的元素符号是___________。H元素和He元素的本质区別是___________不同。
(2)根据结构示意图判断,钙元素位于元素周期表中第___________周期___________族。
(3)画出铝原子的结构示意图是__________;在化学反应中铝原子容易失去电子形成__________(用离子符号表示);与硝酸根离子结合形成的化合物的化学式为___________,该物质的名称读作__________。
【答案】92 Th 质子数 四 ⅡA 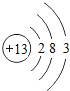 Al3+ Al(NO3)3 硝酸铝
Al3+ Al(NO3)3 硝酸铝
【解析】
(1)根据元素周期表的意义可知:铀元素的原子序数为92;钍的元素符号是Th,质子数决定元素的种类,H元素和He元素的本质区别是质子数或核电荷数不同;
(2)电子层数决定周期数,根据结构示意判断,钙元素位于元素周期表中第四周期第Ⅱ主族;
(3)铝原子核内有13个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有3个电子,其原子结构示意图为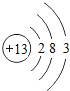 ;最外层上有3个电子,在化学反应中易失去3个电子而形成带3个单位正电荷的铝离子,铝离子的离子符号为:Al3+;与硝酸根离子结合形成的化合物的化学式为Al2(NO3)3,该物质的名称读作硝酸铝。
;最外层上有3个电子,在化学反应中易失去3个电子而形成带3个单位正电荷的铝离子,铝离子的离子符号为:Al3+;与硝酸根离子结合形成的化合物的化学式为Al2(NO3)3,该物质的名称读作硝酸铝。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
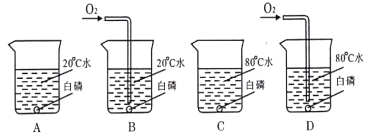
小学生10分钟应用题系列答案【题目】如下图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂) 制取干燥氧气,并用来测定 10g 某铜粉样品(含少量杂质碳)中铜的质量分数。
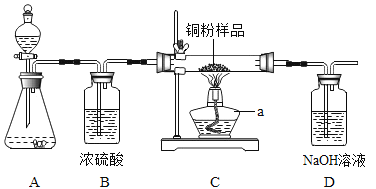
回答下列问题:(温馨提示:2Cu+O2![]() 2CuO;氢氧化钠溶液可以吸收二氧化碳)
2CuO;氢氧化钠溶液可以吸收二氧化碳)
(实验一)
(1)装置A 中发生的化学方程式是__________。装置B的作用是__________。
(2)通过称量完全反应前后装置__________的质量,进行计算便可求出样品中铜的质量分数。
(3)实验完毕,小华同学误将用剩的H2O2溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发同有大量的气泡产生,经检验确认产生的气体是氧气,小江和小田两位同学对此颇感兴趣,进而展开了他们的探究之旅。
(提出问题)
是哪种物质加快了H2O2的分解速率?
(大胆猜想)
猜想①:剩余固体中的氧化铜加快了H2O2溶液的分解。
猜想②:氧化铜能做H2O2分解的催化剂。
(实验二)
实验方案 | 实验现象 | 分析及结论 |
步骤一:将带火星的木条伸入盛有5mL5%过氧化氢溶液的试管。 | 带火星木条不复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星复燃。 |
步骤二:向盛有 5mL5%H2O2溶液的试管中加入 1g 氧化铜固体,将一根带火星的木条伸入试管中。观察现象。待反应结束后将试管里的剩余物进行___________、洗涤、干燥、称量。对比反应前后固体的质量。 | 称得固体质量为 1g | 猜想①成立,并且反应前后固体的质量相等。 |
(讨论交流)
小川同学认为,根据步骤一、二的实验现象,得出的两个结论就能判断猜想②成立。你是否支持他的观点?___________。若要证明猜想②成立,你认为还应补做的实验是___________。
(4)该化学兴趣小组利用压强传感器,对MnO2、CuO、Fe2O3三种金属氧化物中,哪一个更适宜作过氧化氢制取氧气的催化剂,又做了如下数字化实验探究。
(实验三)实验方法如下:
Ⅰ.用MnO2、CuO、Fe2O3三种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用如下图所示装置进行实验。改用其他两种微球,分别重复上述实验,得到的锥形瓶内压强随时间变化的曲线如下图所示。
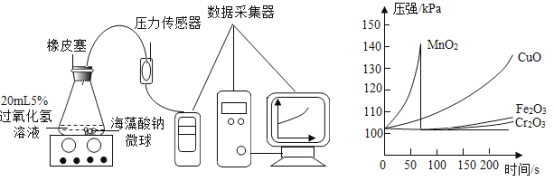
①每次重复实验时,海藻酸钠微球数应相同的原因是_________________________________。
②用含MnO2的海藻酸钠微球进行实验,60s 时压强瞬间回落,其原因可能是____________________。
③从实验曲线看,催化效果较好,反应温和的催化剂是______________________。