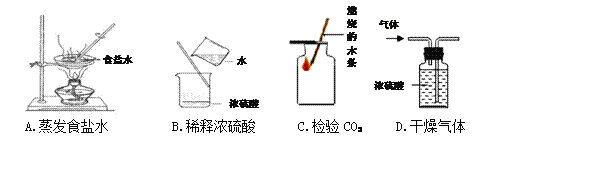
题目内容
【题目】下图为甲、乙两种固体物质的溶解度曲线,下列说法正确的是
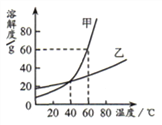
A. 甲物质中混有少量乙物质,采用蒸发结晶的方法提纯甲物质
B. 20℃时,甲物质的溶解度比乙物质的溶解度小
C. 40℃时,甲、乙两种物质的饱和溶液中溶质质量分数相等
D. 60℃时,将80g甲物质放入100g 水中,所得溶液中溶质与溶剂质量之比是4:5
【答案】BC
【解析】A、由溶解度曲线可知,甲、乙的溶解度都随温度的升高而增大,且甲受温度的影响较大,故甲物质中混有少量乙物质,采用降温结晶的方法提纯甲物质,错误;B、由溶解度曲线可知,20℃时,甲物质的溶解度比乙物质的溶解度小,正确;C、由溶解度曲线可知,40℃时,甲、乙两物质的溶解度相等。故40℃时,甲、乙两种物质的饱和溶液中溶质质量分数相等,正确;D、由溶解度曲线可知,60℃时,甲的溶解度为60g。故60℃时,将80g甲物质放入100g 水中,所得溶液中溶质与溶剂质量之比是60g:100g=3:5,错误。故选BC。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】某同学进行如图两个实验。
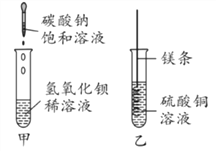
(1)甲实验中反应的化学方程式为________________________________。
(2)乙实验观察到的现象是__________________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(提出猜想)白色沉淀为:Ⅰ.________;
Ⅱ.Mg(OH)2和BaSO4;
Ⅲ.Mg(OH)2和MgCO3。
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为__________________。 ②若________________且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,____________,猜想Ⅲ成立。 |
(反思评价)如果猜想Ⅲ成立,产生此结果的原因是做甲实验时________________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是:_________________。
【题目】甲、乙、丙、丁四位同学分别用质量分数相同的盐酸与相同质量的石灰石样品充分反应,实验测定样品中碳酸钙的质量分数。(样品中的杂质不溶于水,且不与盐酸反应),测得数据如下表:
甲同学 | 乙同学 | 丙同学 | 丁同学 | |
加入盐酸的质量(g) | 20.0 | 30.0 | 45.0 | 50.0 |
剩余固体的质量(g) | 6.0 | 4.0 | 1.0 | 1.0 |
请计算:
(1) 样品与45g盐酸充分反应后,盐酸是否还剩余 (填“是”或“否”),样品中碳酸钙的质量分数是 _。
(2) 产生二氧化碳4.4g需可多少g该样品与足量稀盐酸反应?(写出计算过程,计算结果精确到小数点后一位)