题目内容
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,进行锌、铁、铜的金属活动性顺序探究等实验。
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示:
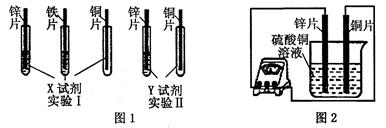
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色。他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至 色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜。和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转 (选填“是”或“否”);
②铜片表面变粗。
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示:

若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色。他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至 色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜。和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转 (选填“是”或“否”);
②铜片表面变粗。
(1)除去金属表面的氧化膜;(2)H2SO4,FeSO4;
(3)浅绿色,Zn+ FeSO4== ZnSO4+Fe;(4)是
(3)浅绿色,Zn+ FeSO4== ZnSO4+Fe;(4)是
试题分析:(1)由于锌等金属在空气中易氧化,故打磨的目的是除去金属表面的氧化膜;
(2)判断金属的活动性,可根据金属与酸反应的快慢或金属与盐溶液是否发生置换反应来判断;
(3)锌的活动性比铜和铁强,故能把铜和铁置换出来;
(4)铜和锌构成原电池,活动性强的为负极,由于锌能与硫酸铜反应,故能产生电流。

练习册系列答案
相关题目