题目内容
化学复习课上,老师将二氧化碳分别通入澄清的石灰水和氢氧化钠溶液中,我们观察到前者变浑浊,后者无明显现象.
我们的疑惑:二氧化碳和氢氧化钠是否确实发生了化学反应?
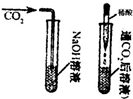
(1)我设计了如图实验装置来验证,实验现象是:软塑料瓶变瘪了.
小军同学认为我的实验是可行的,请你解释其中的原理是:______.
(2)小余同学认为还可以利用上述实验不同的原理,设计如下实验方案,请你帮他完成
| 方案 | 实验步骤 | 滴加试剂 | 实验现象 | 实验结论 |
| 方案 ① | 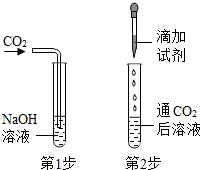 | 稀盐酸 | 现象: ______ | 二氧化碳确实和氢氧化钠发生了化学反应 |
| 方案 ② | ______ | 现象: 有白色沉淀产生 |
解:(1)小军认为上述实验是可行的,原理是:都是一个密闭的体系里氢氧化钠溶液消耗CO2,使得气体压强减少,小于外界压强,在外界压强作用下,软塑料瓶变瘪;
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,检验二氧化碳是否与氢氧化钠反应,可以根据检验碳酸钠的存在来验证,
方案①、碳酸钠和稀酸反应能生成二氧化碳气体,向通有二氧化碳的氢氧化钠溶液中滴加稀盐酸,产生气泡,化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,证明二氧化碳确实与氢氧化钠发生了反应;
方案②、碳酸钠和氯化钙反应生成碳酸钙,将CO2通入NaOH溶液后,再滴加CaCl2溶液,产生白色沉淀,证明二氧化碳确实和氢氧化钠发生了化学反应;
故答案为:(1)氢氧化钠溶液消耗CO2,使气体压强减小;
(2)方案①产生气泡;方案②CaCl2溶液;Na2CO3+2HCl=2NaCl+CO2↑+H2O.
分析:(1)根据二氧化碳能和氢氧化钠溶液反应生成碳酸钠和水,引起压强的变化可以进行判断;
(2)根据二氧化碳能和氢氧化钠溶液反应生成碳酸钠和水,碳酸钠能和盐酸生成二氧化碳,与氯化钙反应生成碳酸钙和氯化钠,来解答.
点评:本题主要探究二氧化碳能否与氢氧化钠反应及其化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,检验二氧化碳是否与氢氧化钠反应,可以根据检验碳酸钠的存在来验证,
方案①、碳酸钠和稀酸反应能生成二氧化碳气体,向通有二氧化碳的氢氧化钠溶液中滴加稀盐酸,产生气泡,化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,证明二氧化碳确实与氢氧化钠发生了反应;
方案②、碳酸钠和氯化钙反应生成碳酸钙,将CO2通入NaOH溶液后,再滴加CaCl2溶液,产生白色沉淀,证明二氧化碳确实和氢氧化钠发生了化学反应;
故答案为:(1)氢氧化钠溶液消耗CO2,使气体压强减小;
(2)方案①产生气泡;方案②CaCl2溶液;Na2CO3+2HCl=2NaCl+CO2↑+H2O.
分析:(1)根据二氧化碳能和氢氧化钠溶液反应生成碳酸钠和水,引起压强的变化可以进行判断;
(2)根据二氧化碳能和氢氧化钠溶液反应生成碳酸钠和水,碳酸钠能和盐酸生成二氧化碳,与氯化钙反应生成碳酸钙和氯化钠,来解答.
点评:本题主要探究二氧化碳能否与氢氧化钠反应及其化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
相关题目

 30、化学复习课上,老师将CO2分别通入澄清的石灰水和NaOH溶液中,我们观察到前者变浑浊,后者无明显现象.CO2和NaOH是否确实发生了化学反应?
30、化学复习课上,老师将CO2分别通入澄清的石灰水和NaOH溶液中,我们观察到前者变浑浊,后者无明显现象.CO2和NaOH是否确实发生了化学反应?


 (2008?怀柔区一模)化学复习课上,老师将CO2分别通入澄清的石灰水和NaOH溶液中,观察到前者变浑浊,后者无明显现象,同学们展开了探究.
(2008?怀柔区一模)化学复习课上,老师将CO2分别通入澄清的石灰水和NaOH溶液中,观察到前者变浑浊,后者无明显现象,同学们展开了探究.