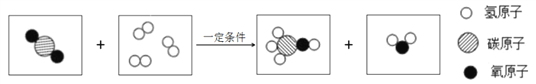
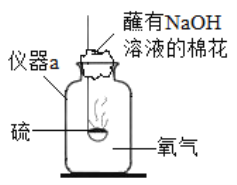
题目内容
【题目】20℃时,将a、b两种固体(均不含结晶水)各20g,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示;升温到50℃时,现象如图2;a、b两种固体的溶解度曲线如图3。
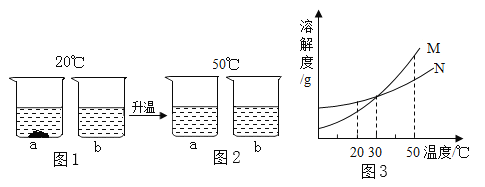
(1)图5中M表示___________(选填:“a”或“b”)的溶解度曲线;
(2)30℃时a、b溶液的溶质质量分数___________;(选填字母)
A.一定相等 B.一定不相等 C.可能相等
(3)图3中b溶液____________(选填:“一定”、“一定不”或“不一定”)是饱和溶液;
(4)若a中混有少量的b,可用______________法来提纯a;
(5)图4中a溶液的溶质质量分数为________________。(结果精确到0.1%)
【答案】 a A 不一定 降温结晶 16.7%
【解析】(1)图3中M表示a的溶解度曲线;
(2)30℃时a、b溶液的溶质质量分数可能相等,因为没有指明溶液是否饱和;故为:C;
(3)图1中b溶液可能恰好饱和,也可能不饱和,因此是不一定;
(4)若a中混有少量的b,可用降温结晶法来提纯a,因为M的溶解度随温度的升高变化比N大;
(5)图2中a溶液的溶质质量分数=![]() ≈16.7%。
≈16.7%。

【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙。
【查阅资料】
I、白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ、碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ、钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ、钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水。
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)同学们设计了以下实验装置:
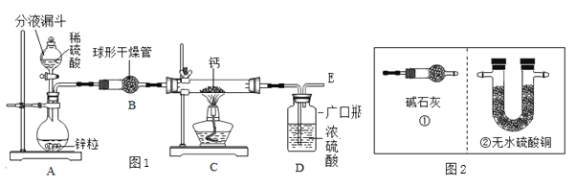
请回答:
①装置A中发生反应的化学方程式为____________________;为了实验安全,点燃C装置酒精灯前应先__________________;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的__________(选填:①或②)装置;
③图1装置D中浓硫酸的作用是__________________;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与Ca比,完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,在干燥条件下与氧气反应,将其产物通入装有无水硫酸铜的干燥管; | ___________________ |
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数。
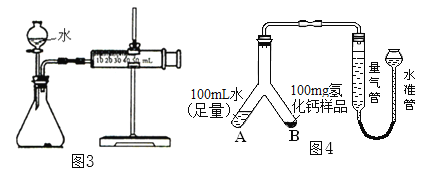
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在_______时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是___________________;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL。将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL。已知该实验条件下,氢气的密度为0.09mg/mL。样品中氢化钙的质量分数为_______________;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?
你的观点是________________________。