题目内容
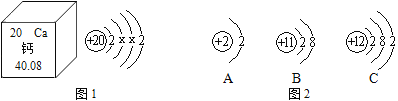
【题目】如图分别是钾元素、氢元素、氧元素、钠元素的原子结构示意图
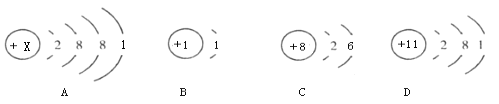
(1)A中X的值为________;
(2)A、D化学性质相似的原因是_____________;
(3)如图氧元素、氢元素的质子数分别为8和1,则一个OH- (氢氧根离子)的质子数为_________;
(4)AC形成的物质的化学式为______________。
【答案】 19 最外层电子数相等 9 K2O
【解析】(1)、A图是一种结构示意图,故X=2+8+8+1=19;
(2)、AD的最外层的电子数都是1,故化学性质相似;
(3)、核外的电子可以得失,但是质子不能得失,故氢氧根离子的质子数为1+8=9;
(4)A原子的最外层电子数是1,在化合物中显+1价,C原子的最外层电子数是6 ,在化合物中显-2价,故形成的化学式是K2O;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】从“丝绸之路”到“一带一路”的倡议促进了东西方经济、文化的交流和发展。
请从A、B两题中任选一个作答,并在答题纸上将所选的【A】或【B】用2B铅笔填涂为黑色。若两题均作答,计一道题分。
A | B |
“丝绸之路”把中国的丝绸茶叶传入西方,将西方的宝石传入中国。茶叶中含有维生素C,其化学式为C6H8O6,C6H8O6由______种元素组成。宝石的成分复杂,其中含有的Al2O3属于_____(填“单质”或“氧化物”), Al2O3中Al元素的化合价是_____。 | 能源合作是“一带一路”的重要内容,中缅油气管道将石油和天然气输入中国,石油属于____(选填“纯净物”或“混合物”)。天然气的主要成分是CH4 , CH4中碳、氢元素的质量比为_____,CH4完全燃烧生成CO2和____。 |