题目内容
(5分) Fe2O3在一定条件下可转化为Fe0:Fe2O3+ C0高温2Fe0+C02,反应前Fe2O3的质量为160克,反应过程中,Fe2O3的转化率(参加反应的Fe2O3与反应前的Fe2O3的质量比)用a表示,固体中铁元素与氧元素的质量比用mFe/m Fe0表示。
(1)填写下表中的空格:

(2)如果Fe2O3转让为Fe0的反应分两步进行:3 Fe2O3十C0高温2 Fe3O4十CO2
Fe304十3C0高温2FeO十CO2
反应后的固体中mFe/mO===21/8时固体的成分可能有三种情况:
(1) Fe3O4 (2)▲ (填化学式、下同) (3)▲ .
(1)填写下表中的空格:

(2)如果Fe2O3转让为Fe0的反应分两步进行:3 Fe2O3十C0高温2 Fe3O4十CO2
Fe304十3C0高温2FeO十CO2
反应后的固体中mFe/mO===21/8时固体的成分可能有三种情况:
(1) Fe3O4 (2)▲ (填化学式、下同) (3)▲ .
(1)FeO(1分) 50﹪(或0.5 2分)
(2) Fe2O3和FeO(1分) Fe3O4、Fe2O3和FeO (1分位置可调换)
(2) Fe2O3和FeO(1分) Fe3O4、Fe2O3和FeO (1分位置可调换)
分析:(1)根据Fe2O3的转化率是参加反应的Fe2O3与反应前的Fe2O3的质量比及固体中铁元素与氧元素的质量比,利用反应前Fe2O3的质量为160克代入化学反应方程式来解答;
(2)根据反应后的固体中mFe/mO═21/8时,利用极限法来假设只生成氧化铁或氧化亚铁,先计算铁与氧元素的质量比再推测固体的成分.
解答:解:(1)根据Fe2O3+C0高温2Fe0+C02,Fe2O3的转化率是参加反应的Fe2O3与反应前的Fe2O3的质量比,
由表格中的转化率为100%可知,氧化铁全部反应,
则固体成分为FeO,氧化亚铁中Fe、O元素的质量比为56:16=7:2,符合题意;
当中mFe/mO═14/5时,设参加反应的氧化铁的质量为x,
则 Fe2O3+C0高温2Fe0+C02,
160 144
x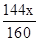
由反应后铁与氧元素的质量比得,
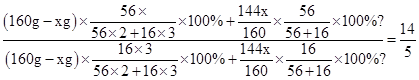 ,
,
解得x=80g,
则转化率为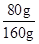 ×100%=50%,
×100%=50%,
故答案为:FeO;50%;
(2)由反应可知,反应后的固体有四氧化三铁、也可能有氧化亚铁,
若只有四氧化三铁,在Fe3O4中,铁、氧元素的质量比为56×3:16×4=21:8,则可能反应后固体只有四氧化三铁;
在Fe2O3中铁、氧元素的质量比为56×2:16×3=7:3=21:9,
若只有氧化亚铁,在FeO中Fe、O元素的质量比为56:16=7:2=21:6,
则7:3<21:8<Fe2O3<7:2,
则反应后固体可能为氧化铁和氧化亚铁的混合物,也可能为氧化铁、氧化亚铁、四氧化三铁的混合物,
故答案为:Fe2O3和FeO;Fe3O4、Fe2O3和FeO.
点评:本题计算较复杂,考查学生利用化学反应方程式及利用信息中转化率、元素质量比的计算,学生应充分利用信息并结合质量分数的概念、极限法、平均值法来综合应用解答本题.
(2)根据反应后的固体中mFe/mO═21/8时,利用极限法来假设只生成氧化铁或氧化亚铁,先计算铁与氧元素的质量比再推测固体的成分.
解答:解:(1)根据Fe2O3+C0高温2Fe0+C02,Fe2O3的转化率是参加反应的Fe2O3与反应前的Fe2O3的质量比,
由表格中的转化率为100%可知,氧化铁全部反应,
则固体成分为FeO,氧化亚铁中Fe、O元素的质量比为56:16=7:2,符合题意;
当中mFe/mO═14/5时,设参加反应的氧化铁的质量为x,
则 Fe2O3+C0高温2Fe0+C02,
160 144
x
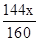
由反应后铁与氧元素的质量比得,
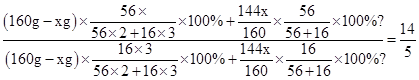 ,
,解得x=80g,
则转化率为
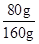 ×100%=50%,
×100%=50%,故答案为:FeO;50%;
(2)由反应可知,反应后的固体有四氧化三铁、也可能有氧化亚铁,
若只有四氧化三铁,在Fe3O4中,铁、氧元素的质量比为56×3:16×4=21:8,则可能反应后固体只有四氧化三铁;
在Fe2O3中铁、氧元素的质量比为56×2:16×3=7:3=21:9,
若只有氧化亚铁,在FeO中Fe、O元素的质量比为56:16=7:2=21:6,
则7:3<21:8<Fe2O3<7:2,
则反应后固体可能为氧化铁和氧化亚铁的混合物,也可能为氧化铁、氧化亚铁、四氧化三铁的混合物,
故答案为:Fe2O3和FeO;Fe3O4、Fe2O3和FeO.
点评:本题计算较复杂,考查学生利用化学反应方程式及利用信息中转化率、元素质量比的计算,学生应充分利用信息并结合质量分数的概念、极限法、平均值法来综合应用解答本题.

练习册系列答案
相关题目

