��Ŀ����
����Ŀ���������ƣ�NaN3�����㷺Ӧ����������ȫ���ң�ij��ѧС��ͬѧ������������о���
���������ϡ�
��NaN3��ײ��������Na��N2
��NaN3�����ᡢH2SO4��Һ����������
�ۼ�ʯ����CaO��NaOH�Ļ����
��NaN3���Ʊ������ǣ�����������Һ̬����Ӧ�Ƶ�NaNH2 �� �ٽ�NaNH2��N2O��Ӧ������NaN3��NaOH��NH3
������̽����
��1��������ײ����30����������NaN3Ѹ�ٷֽ⣬�÷�Ӧ�Ļ�ѧ����ʽΪ��
��2����ҵ��NaN3�г�����������Na2CO3 �� ��ԭ�������û�ѧ����ʽ��ʾ����
��3��Ϊ�ⶨij��ҵ��NaN3��Ʒ��Na2CO3������������С��ͬѧ�������ͼʵ��װ�D��
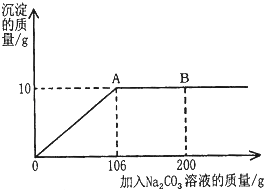
��С��ͬѧ��Ϊͨ���ⶨװ��I�з�Ӧǰ��B���������ͨ����Ӧ���㣬�ͿɲⶨNa2CO3������������С��ͬѧͨ��������Ϊ�����У������ɿ����������һ�ּ��ɣ���
��С��ͬѧ�ڴ�����۵Ļ����ϣ��������װ�D���������װ�â���A�������� �� ����װ��C���Բⶨ�����ɵ�Ӱ�������ƫ����ƫС������Ӱ�족����װ��E�������� ��
�۸���װ�â�С��ͬѧ��Ƶ�ʵ�鲽���У�
a������װ��D
b��������Ʒ�����װ��������
c�����ɼУ��������
d���رյ��ɼУ���Һ©���Ļ����Ͳ�������ע��������ϡ���ᣬ�رջ����Ͳ�������
����ȷ��˳��Ϊ������ĸ��ţ����ظ�����
�ܼ���̼���Ƶ���������ʱ��������Ҫ�ⶨ�����ݣ��������֣�
���𰸡�
��1��2NaN3![]() 2Na+3N2
2Na+3N2
��2��2NaOH+CO2�TNa2CO3+H2O
��3��Ũ�����ӷ����������Ȼ������屻װ��B���գ����տ����еĶ�����̼��ˮ������ƫ���������̼�Ƿ�Dװ����ȫ���գ�bcadca��3
����������1��������ײ����30����������NaN3Ѹ�ٷֽ�ΪNa��N2 �� ����Ӧ����NaN3 �� ��������Na��N2 �� ������ײ�������Է�Ӧ����ʽΪ2NaN3![]() 2Na+3N2����2�����ݹ�ҵ��NaN3��ԭ�������Ʊ���������NaOH���ɣ�NaOH�Ϳ����е�CO2��Ӧ����̼���ƣ���ѧ����ʽΪ��2NaOH+CO2�TNa2CO3+H2O����3��Ҫ�ⶨij��ҵ��NaN3��Ʒ�к���Na2CO3����������������NaN3�����ᡢH2SO4��Һ���������ɣ���Na2CO3�����ᡢH2SO4��Һ����CO2���壬��CO2�������������Na2CO3���������������Na2CO3������������
2Na+3N2����2�����ݹ�ҵ��NaN3��ԭ�������Ʊ���������NaOH���ɣ�NaOH�Ϳ����е�CO2��Ӧ����̼���ƣ���ѧ����ʽΪ��2NaOH+CO2�TNa2CO3+H2O����3��Ҫ�ⶨij��ҵ��NaN3��Ʒ�к���Na2CO3����������������NaN3�����ᡢH2SO4��Һ���������ɣ���Na2CO3�����ᡢH2SO4��Һ����CO2���壬��CO2�������������Na2CO3���������������Na2CO3������������
��װ�� I��Ũ��������Ʒ��Ӧ��Ũ������лӷ��ԣ��������Ȼ������屻װ��B���գ�������̼�����ݳ�ʱ������ˮ������װ��B�������������գ�װ��A��B�ڿ����еĶ�����̼��װ��B���գ�A�����ɵĶ�����̼����ȫ������Bװ�ã�ʹʵ��������ȣ�
��װ��II��A��ҩƷ�Ǽ�ʯ�ң���ʯ�ҿ���������������տ����е�ˮ�ֺͶ�����̼����ֹ������ˮ�����Ͷ�����̼�������飻Cװ�õ�Ũ�������CO2���壬����Cװ�û�ʹʵ����ƫ��CO2ͨ�����ʯ��ˮ��ʹ����ʯ��ˮ����ǣ�װ��E�������Ǽ��������̼�Ƿ�Dװ����ȫ���գ���ֹ�����еĶ�����̼��ˮ��������Dװ�ã�
�۸���װ��II��С��ͬѧ��Ƶ�ʵ�鲽��Ϊ��������Ʒ�����װ�������ԣ����ɼУ��������������װ��D����Һ©���Ļ����Ͳ�������ע��������ϡ���ᣬ�رջ����Ͳ����������ɼУ��������������װ��D������ȷ˳��Ϊbcadca��
�ܼ���̼���Ƶ���������ʱ��������Ҫ�ⶨ3�����ݣ�������װ��+ϡ����������װ��+ϡ��������+������
���Դ��ǣ���1��2NaN3�T2Na+3N2������2��2NaOH+CO2�TNa2CO3+H2O����3����Ũ�����ӷ����������Ȼ������屻װ��B���գ�������̼�����ݳ�ʱ������ˮ������װ��B�������������գ�װ��A��B�ڿ����еĶ�����̼��װ��B���գ�A�����ɵĶ�����̼����ȫ������Bװ�ã�ʹʵ������������ӵ������ٴ������һ�����ɣ������տ����еĶ�����̼��ˮ������ƫ���������̼�Ƿ�Dװ����ȫ���գ���ֹ�����еĶ�����̼��ˮ��������Dװ�ã������ǰһ�㼴�ɣ���bcadca����3��
�����㾫����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�ǽ����ĸ�������Ҫ֪��ע�⣺a����ƽ b������ c�����ţ�

 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�