题目内容
(8分)钢铁的生产和使用是人类文明和社会进步的一个重要的标志。
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是
。
校课外兴趣小组的同学们去潍坊某钢铁长生铁样品进行实验:将四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加到100g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4LH2的质量为2g)
通过计算回答下列问题:
①上述表格中m的值为 。
②根据表中数据计算稀硫酸中H2SO4的质量分数。
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是
。
校课外兴趣小组的同学们去潍坊某钢铁长生铁样品进行实验:将四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加到100g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4LH2的质量为2g)
| 实验序号 | 1 | 2 | 3 | 4 |
| 生铁样品的质量 / g | 2.88 | 5.76 | 9.24 | 10.28 |
| 生成H2的体积(标准状况下)/L | 1.12 | 2.24 | 3.36 | m |
①上述表格中m的值为 。
②根据表中数据计算稀硫酸中H2SO4的质量分数。
(1)铁与空气中的氧气和水蒸气发生反应
(2)①3.36
②解:据实验3进行计算
生成H2的质量为: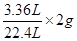 =0.3g
=0.3g
设生成H2SO4的质量为x
Fe+H2SO4==FeSO4+H2↑
2
X 0.3g
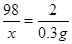
X=14.7g
稀硫酸中H2SO4的质量分数为: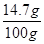 ×100%=14.7%
×100%=14.7%
答:(略)
(2)①3.36
②解:据实验3进行计算
生成H2的质量为:
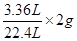 =0.3g
=0.3g设生成H2SO4的质量为x
Fe+H2SO4==FeSO4+H2↑
2
X 0.3g
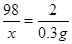
X=14.7g
稀硫酸中H2SO4的质量分数为:
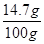 ×100%=14.7%
×100%=14.7%答:(略)
分析:(1)根据铁生锈的条件考虑本题;(2)由第1、2两次可知2.88g样品只能生成1.12L氢气,所以5.76g生成2.24L氢气,8.64g能生成3.36L氢气,再进行进一步计算.,根据硫酸全部参加反应的那一次进行计算,算出硫酸的质量再除以硫酸溶液的质量乘以百分之百.
解答:解:(1)铁生锈的条件是铁与空气中的氧气和水共同作用的结果;
(2)由第1、2两次可知2.88g样品只能生成1.12L氢气,所以5.76g生成2.24L氢气,8.64g能生成3.36L氢气,结果图示中表明是9.24g生铁样品与100g硫酸反应得到3.36L氢气,这说明生铁样品过量,硫酸已经被全部反应完,所以再加入生铁生成氢气的量也不会变,所以m值为3.36L.根据氢气的质量:
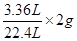 ×2g=0.3g,设要生成0.3g氢气需要参加反应的硫酸的质量为X,则:
×2g=0.3g,设要生成0.3g氢气需要参加反应的硫酸的质量为X,则:
Fe+H2SO4═FeSO4+H2↑
98 2
x 0.3g
根据: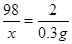
解得X=14.7g,所以硫酸溶液中H2SO4的质量分数为: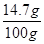 ×100%=14.7%.
×100%=14.7%.
故答案为:(1)铁与空气中的氧气和水蒸气共同作用的结果;(2)3.36;14.7%.
点评:解答本题的关键是根据图表中的数据计算出第3次生铁已过量,硫酸已全部参加了反应,再进行进一步计算.
解答:解:(1)铁生锈的条件是铁与空气中的氧气和水共同作用的结果;
(2)由第1、2两次可知2.88g样品只能生成1.12L氢气,所以5.76g生成2.24L氢气,8.64g能生成3.36L氢气,结果图示中表明是9.24g生铁样品与100g硫酸反应得到3.36L氢气,这说明生铁样品过量,硫酸已经被全部反应完,所以再加入生铁生成氢气的量也不会变,所以m值为3.36L.根据氢气的质量:
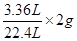 ×2g=0.3g,设要生成0.3g氢气需要参加反应的硫酸的质量为X,则:
×2g=0.3g,设要生成0.3g氢气需要参加反应的硫酸的质量为X,则:Fe+H2SO4═FeSO4+H2↑
98 2
x 0.3g
根据:
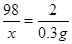
解得X=14.7g,所以硫酸溶液中H2SO4的质量分数为:
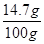 ×100%=14.7%.
×100%=14.7%.故答案为:(1)铁与空气中的氧气和水蒸气共同作用的结果;(2)3.36;14.7%.
点评:解答本题的关键是根据图表中的数据计算出第3次生铁已过量,硫酸已全部参加了反应,再进行进一步计算.

练习册系列答案
相关题目

 2CuSO4+2H2O
2CuSO4+2H2O