题目内容
质量守恒定律是初中化学中的一条重要规律.请利用质量守恒定律的相关知识回答下列问题.
(1)蜡烛在空气中充分燃烧时,产物为二氧化碳和水,则蜡烛中一定含有的元素是
(2)将ag氯酸钾与bg 二氧化锰充分混合、加热,待完全反应后,称得剩余固体质量为cg.由以上信息可知:生成物中氯化钾的质量为
(可能用到的相对原子质量:K-39;Cl-35.5;O-16;Mn-55)
(1)蜡烛在空气中充分燃烧时,产物为二氧化碳和水,则蜡烛中一定含有的元素是
C、H
C、H
(用元素符号填空),理由是依据质量守恒定律,化学反应前后元素的种类不会改变,蜡烛燃烧产物水和二氧化碳中含有碳、氢、氧三种元素,由于空气中的氧气参加了反应,因此蜡烛中一定含有的元素是碳元素和氢元素
依据质量守恒定律,化学反应前后元素的种类不会改变,蜡烛燃烧产物水和二氧化碳中含有碳、氢、氧三种元素,由于空气中的氧气参加了反应,因此蜡烛中一定含有的元素是碳元素和氢元素
.(2)将ag氯酸钾与bg 二氧化锰充分混合、加热,待完全反应后,称得剩余固体质量为cg.由以上信息可知:生成物中氯化钾的质量为
c-b
c-b
g,氧气的质量为a+b-c
a+b-c
g.(可能用到的相对原子质量:K-39;Cl-35.5;O-16;Mn-55)
分析:(1)根据质量守恒定律,在化学反应中反应前后元素的种类没有改变,据此答题.
(2)根据质量守恒定律,参加化学反应的各物质质量总和等于反应后生成的各物质质量总和考虑本题.
(2)根据质量守恒定律,参加化学反应的各物质质量总和等于反应后生成的各物质质量总和考虑本题.
解答:解:(1)蜡烛燃烧产物水和二氧化碳中含有碳、氢、氧三种元素,由于空气中的氧气参加了反应,依据质量守恒定律,化学反应前后元素的种类不会改变,故可推断石蜡中一定含有碳、氢两种元素,可能含有氧元素.
(2)根据“完全反应后,称得剩余固体质量为cg”可知cg中包含生成的氯化钾的质量和二氧化锰的质量,因此生成物中氯化钾的质量为(c-b)g;根据质量守恒定律,参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量和,由于氧气跑出去了,所以反应后质量的减少量就是生成的氧气的质量,由于剩余固体的质量为c g中包含着二氧化锰,所以在计算质量的减少量时必须加上二氧化锰的质量,所以生成氧气的质量为:(a+b-c)g.
故答案为:(1)C、H;依据质量守恒定律,化学反应前后元素的种类不会改变,蜡烛燃烧产物水和二氧化碳中含有碳、氢、氧三种元素,由于空气中的氧气参加了反应,因此蜡烛中一定含有的元素是碳元素和氢元素;
(2)c-b;a+b-c.
(2)根据“完全反应后,称得剩余固体质量为cg”可知cg中包含生成的氯化钾的质量和二氧化锰的质量,因此生成物中氯化钾的质量为(c-b)g;根据质量守恒定律,参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量和,由于氧气跑出去了,所以反应后质量的减少量就是生成的氧气的质量,由于剩余固体的质量为c g中包含着二氧化锰,所以在计算质量的减少量时必须加上二氧化锰的质量,所以生成氧气的质量为:(a+b-c)g.
故答案为:(1)C、H;依据质量守恒定律,化学反应前后元素的种类不会改变,蜡烛燃烧产物水和二氧化碳中含有碳、氢、氧三种元素,由于空气中的氧气参加了反应,因此蜡烛中一定含有的元素是碳元素和氢元素;
(2)c-b;a+b-c.
点评:此题是对质量守恒定律的考查,元素的种类在化学反应前后是不变的,因此根据生成物中元素的种类可以判断反应物中元素的种类.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
高寒地区获得氢气的方法之一,是用氢化钙(CaH2)与水反应放出氢气,生成对应的碱.请回答下面问题:
(1)请根据质量守恒定律和已学过的化学知识,猜想并写出发生反应的化学方程式______;
(2)请利用初中化学知识设计实验,证明两种生成物并完成实验报告填写在下表中.
(1)请根据质量守恒定律和已学过的化学知识,猜想并写出发生反应的化学方程式______;
(2)请利用初中化学知识设计实验,证明两种生成物并完成实验报告填写在下表中.
| 实验的主要步骤 | 实验的主要现象 | 结论 |
| ①取少量的氢化钙固体,放入试管中,加入适量水,塞紧带导管的塞子,然后用另一支试管收集产生的气体,用拇指堵住管口,倒置后,再______________________ | ||
| ②取少量反应后的剩余糊状物,放入试管中,________________ |
 (2013?衡阳)小林同学在做探究质量守恒定律实验时,称取2.4g镁条在点燃的条件下与充足的空气反应,其反应的化学方程式为
(2013?衡阳)小林同学在做探究质量守恒定律实验时,称取2.4g镁条在点燃的条件下与充足的空气反应,其反应的化学方程式为 反应呢?
反应呢?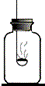 ①2Mg+CO2
①2Mg+CO2 C+2MgO ②3Mg+N2
C+2MgO ②3Mg+N2 Mg3N2
Mg3N2 反应呢?
反应呢?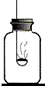 ①2Mg+CO2
①2Mg+CO2 C+2MgO ②3Mg+N2
C+2MgO ②3Mg+N2 Mg3N2
Mg3N2