题目内容
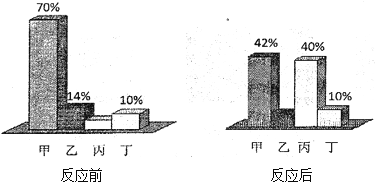
【题目】取KCl和CaCl2混合物15g,加入35g水完全溶解后,逐滴加入溶质质量分数为27.6%的K2CO3溶液,所加K2CO3溶液的质量的质量与生成沉淀质量的关系如图所示:

(1)恰好完全反应时,需要K2CO3溶液的质量为______ g.
(2)计算原混合溶液中含氯化钙的质量.
(3)计算恰好完全反应后,所得溶液中溶质的质量分数(精确到0.1%)
【答案】(1)50;(2)11.1g;(3)20.9%
【解析】(1)碳酸钾与氯化钙反应生成碳酸钙沉淀和氯化钾,当沉淀不再增加时表示碳酸钾与氯化钙恰好完全反应。由图可知,恰好完全反应时,需要K2CO3溶液的质量为50g;(2)利用化学方程式,根据碳酸钙与氯化钙反应的质量比即可计算出氯化钙的质量。
设氯化钙的质量为x,生成了氯化钾的质量为y;
K2CO3 + CaCl2 == CaCO3↓ + 2KCl
111 100 149
X 10g y
![]() x=11.1g
x=11.1g
![]() y=14.9g
y=14.9g
(3)原混合物中氯化钾的质量=15g-11.1g=3.9g
氯化钾的总质量=14.9g+3.9g=18.8g
反应后溶液的质量=15g+35g+50g-10g=90g
恰好完全反应后,所得溶液中溶质的质量分数=![]() 20.9%
20.9%
答:恰好完全反应时,需要K2CO3溶液的质量为50g;原混合溶液中含氯化钙的质量为11.1g;恰好完全反应后,所得溶液中溶质的质量分数为20.9%。

【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解 释 | 集气瓶中的水: 吸收放出的热量 | 量筒中的水: 通过水体积的变化 得出O2体积 | 集气瓶中的水: 冷却溅落融熔物, 防止集气瓶炸裂 | 集气瓶中的水:先将集 气瓶内的空气排净,后 便于观察H2何时收集满 |
A. A B. B C. C D. D