题目内容
【题目】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔。
海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.13 | 0.56 | ||||
1.20 | 0.91 | ||||
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如上表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
①海水从密度为1.21g/ml浓缩到1.22g/ml时下列说法正确的是___________
A.各种盐的溶解度增大
B.海水中NaBr的质量分数不变
C.析出粗盐中NaCl的质量分数增大
D.海水中水的质量分数不变
②海水在浓缩过程中,最先析出的盐是__________。
(2)工业上利用粗盐水(含有少量CaCl2、MgCl2)生产纯碱,工艺流程如下图:
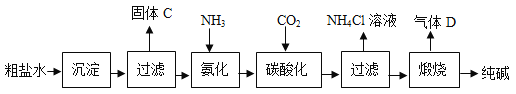
已知:ⅰ常温下,NH3极易溶于水,CO2能溶于水;
ⅱNaHCO3加热易分解,Na2CO3加热不易分解。
完成下列填空:
①粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为__________;
②流程中,先“氨化”后“碳酸化”的目的是__________;
③“碳酸化”后过滤获得的NH4Cl可用作__________肥,也可先__________(填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是__________;
④“煅烧”时,NaHCO3分解生成的气体D是__________,若将气体D直接排入空气不合理的理由是__________。
(3)海滨研究所以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1:

请回答下列问题:
①操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、__________。
②以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式__________。
③操作Ⅱ酸化时应选择的酸是__________(填写化学式)。
④上述反应中未涉及的基本反应类型是__________(填写字母)。
a.复分解反应 b.置换反应 c.化合反应 d.分解反应
⑤回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成甲烷和氧气,该反应的化学方程式为__________。紫外线照射时,在不同催化剂(①、②、③)的作用下,甲烷产量随光照时间的变化如图2所示,在第10小时时甲烷产量最高是__________(填写“①”、“②”、或“③”)。
【答案】 C 硫酸钙或CaSO4 Mg(OH)2、CaCO3 氨化后溶液显碱性,提高二氧化碳吸收率 氮(化) 加热 NH3 CO2或二氧化碳 造成(加重)温室效应 漏斗 Ca(OH)2+MgCl2=Mg(OH)2 ↓+CaCl2 HCl b CO2+2H2O ![]() CH4+2O2 ②
CH4+2O2 ②
【解析】(1)①海水浓缩过程是水分减少过程,溶质不变,溶剂减少,溶质质量分数增大,温度不变溶解度不变,所以只有C正确;②由表中数据可知最先析出的是硫酸钙,因为海水密度为1.13g/ml时就已经有硫酸钙析出;
(2)①NaOH和MgCl2反应生成Mg(OH)2沉淀和NaCl,Na2CO3和CaCl2反应生成CaCO3沉淀和NaCl;NaOH和MgCl2、Na2CO3和CaCl2反应的化学方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl和Na2CO3+CaCl2=CaCO3↓+2NaCl;
②氨气溶于水溶液显碱性,有利于二氧化碳的吸收;
③农作物生长需大量的N、P、K元素,含有N元素的肥料属于氮肥;所以“碳酸化”后过滤获得的NH4Cl可用作氮肥;NH4Cl在加热的条件下分解为氨气和氯化氢:NH4Cl ![]() NH3↑+HCl↑,该反应中生成的氨气(NH3)可以利用在工业生产纯碱工艺流程中的“氨化”环节;
NH3↑+HCl↑,该反应中生成的氨气(NH3)可以利用在工业生产纯碱工艺流程中的“氨化”环节;
④碳酸氢钠受热分解:2NaHCO3 ![]() Na2CO3+H2O+CO2↑,二氧化碳属温室气体,还能循环使用二氧化碳节约资源。
Na2CO3+H2O+CO2↑,二氧化碳属温室气体,还能循环使用二氧化碳节约资源。
(3)①过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
②由反应的流程可知,除去Mg2+时,加氢氧化钙,氯化镁转化为氢氧化镁的反应是氯化镁与氢氧化钙反应生成了氢氧化镁沉淀和氯化钙,反应的化学方程式是: Ca(OH)2+ MgCl2=Mg(OH)2↓+ CaCl2;
③该过程是制取CaCl2,Ⅱ中的酸只能是盐酸;
④贝壳成分是碳酸钙,碳酸钙高温煅烧生成氧化钙和二氧化碳,属于分解反应;氧化钙和水反应生成氢氧化钙,属于化合反应;氢氧化镁能和盐酸反应生成氯化镁和水,属于复分解反应,而电解MgCl2生成金属镁和氯气,属于分解反应,所以没有涉及的基本反应类型是置换反应; CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成CH4和O2,反应的化学方程式为CO2+2H2O![]() CH4+2O2。根据图示可以看出,在第10小时时CH4产量最高的是②。
CH4+2O2。根据图示可以看出,在第10小时时CH4产量最高的是②。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案【题目】根据所给的信息和标志,判断下列说法错误的是
A | B | C | D |
《淮南万毕术》中记载,曾青得铁则化为铜。 | 《梦溪笔谈》中记载,鄜、延境内有石油,旧说“高奴县出脂水”,即此也。 |
|
|
是现代湿法冶金的先驱 | 这里的石油指的是一种油脂 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
A. A B. B C. C D. D


