题目内容
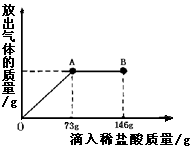
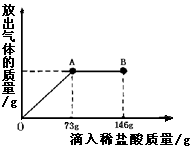
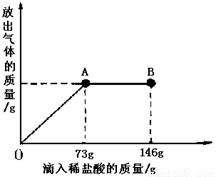
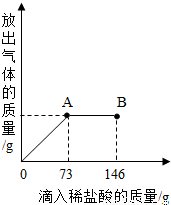
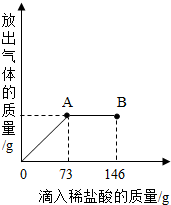 在一烧杯中盛有21.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总量与所滴入盐酸的质量关系曲线如右图所示,请根据题意回答问题:
在一烧杯中盛有21.4g Na2CO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总量与所滴入盐酸的质量关系曲线如右图所示,请根据题意回答问题:(1)Na2CO3恰好完全反应点是
(2)原固体中Na2CO3的质量分数是多少?(计算结果精确到0.1%)
(3)当滴加稀盐酸至图中A点时,烧杯中溶质的质量分数是多少?
分析:根据图象不难看出,当滴加稀盐酸至图中A点时,生成的气体的质量不再增加,说明碳酸钠已刚好完全反应,若再加稀盐酸则表明盐酸已过量,即说明参加反应的稀盐酸的量是73g,把稀盐酸中溶质的质量代入化学方程式进行计算就可求出有关的量;求反应后所得的质量可以根据加入物质的总质量-难溶于水也不参加反应的杂质的质量-生成的气体或沉淀的质量.
解答:解:(1)从图象中不难看出,当滴加稀盐酸到A时,二氧化碳的质量不再增加,说明碳酸钠已完全反应,若再滴加稀盐酸,则就过量,故答案为:A,<
设原固体中含碳酸钠的质量为x,生成NaCl质量为y,生成CO2的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x 73g×10% y z
=
x=
=10.6g
=
y=
=11.7g
=
z=
=4.4g
(2)原固体中Na2CO3的溶质质量分数=
×100%=49.5%
(3)A点时烧杯中溶质的质量分数=
×100%=25%
答:原固体中碳酸钠的质量分数为49.5%,A点时烧杯中溶质的质量分数为25%.
设原固体中含碳酸钠的质量为x,生成NaCl质量为y,生成CO2的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x 73g×10% y z
| 106 |
| 73 |
| x |
| 73g×10% |
| 106×73g×10% |
| 73 |
| 73 |
| 117 |
| 73g×10% |
| y |
| 117×73g×10% |
| 73 |
| 73 |
| 44 |
| 73g×10% |
| z |
| 44×73g×10% |
| 73 |
(2)原固体中Na2CO3的溶质质量分数=
| 10.6g |
| 21.4g |
(3)A点时烧杯中溶质的质量分数=
| 21.4g-10.6g+11.7g |
| 21.4g+73g-4.4g |
答:原固体中碳酸钠的质量分数为49.5%,A点时烧杯中溶质的质量分数为25%.
点评:本题难度较大,主要考查了根据化学方程式进行计算和有关溶液中溶质质量分数的计算,从而培养学生对概念的应用和分析问题、解决问题的能力.

练习册系列答案
相关题目