题目内容
【题目】下图为元素周期表中某一周期元素的原子结构示意图,请回答下列问题。

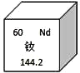
(1)表中磷原子的核电荷数x=________.
(2)氯原子最外层有____个电子,在化学反应中易____(得或失)电子
(3)镁元素与氯元素的本质区别是________镁离子符号________.
(4)根据钾原子的原子结构示意图,判断表中与其化学性质相似的是________

(5)表中具有相对稳定结构的元素是________.
(6)上述元素在周期表中处于同一周期的原因是________.
【答案】15 7 得 质子数不同 Mg2+ 钠原子 氩 原子核外电子层数相同
【解析】
(1)根据“核内质子数=核电荷数=核外电子数”,故x=2+8+5=15;
(2)由图中原子结构示意图:氯原子最外层有7个电子,是非金属元素的原子所以在化学反应中易得电子;
(3)镁元素与氯元素的本质区别是质子数不同;镁离子符号Mg2+;
(4)根据钾原子的原子结构示意图,最外层电子数是1,根据最外层电子数相同,化学性质相似,判断表中与其化学性质相似的是钠原子;
(5)最外层电子数为8(一个电子层最外层是2)属于相对稳定结构,所以表中具有相对稳定结构的元素是氩元素;
(6)原子所处的周期数与该原子的电子层数相同,上述元素在周期表中处于同一周期的原因是原子核外电子层数相同。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】空气中氧气含量测定的再认识.
Ⅰ.(实验回顾)如图是实验室用红磷燃烧来粗略测定空气中氧气含量的装置.
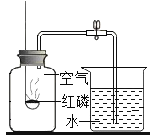
(1)写出红磷燃烧的化学方程式________________,现象是_________.
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内气压减小,烧杯中水倒吸到集气瓶.若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量.
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大.
Ⅱ.(实验改进)
根据铁在空气中生锈的原理设计如图实验装置,再次测定空气中氧气含量.装置中饱和食盐水、活性炭会加速铁生锈.测得实验数据如表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 |
(交流表达)
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式_________.
(2)根据表中数据计算,改进实验后测得的空气中氧气的体积分数是_____(计算结果精确到0.1%).
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是___________;(写一条)
III.四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2Na2S4+O2+2H2O═8S↓+4NaOH
(查阅资料)①Na2S4受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢.
②硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应.
③NaOH溶液可吸收硫化氢和二氧化碳.
(实验过程)
①取0.5g碳酸钠、0.2g硫粉混合后置于试管中,加入(如图①所示,夹持装置已略去),制得Na2S4,反应为:4Na2CO3+12S+X![]() 2Na2S4+2Na2S2O3+4CO2,X的化学式为___________;
2Na2S4+2Na2S2O3+4CO2,X的化学式为___________;
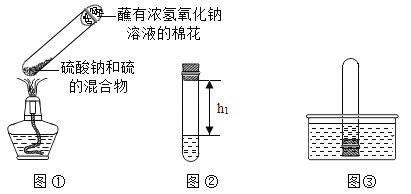
②冷却后,取下棉花,放置一段时间,再向该试管中加入10mL水,迅速塞紧橡胶塞,充分振荡.测量液面至橡胶塞下沿的距离,记录数据h1(如图②所示);
③将该试管插入水中(如图③所示),拔下橡胶塞,观察到_________,塞紧橡胶塞.将试管取出,倒转过来,测量液面至橡胶塞下沿的距离h2,记录数据h2.理论上h2:h1=___________;
④(反思与评价)实验过程①中要塞氢氧化钠溶液的棉花的原因是___________;若实验过程②中,冷却取下棉花后,未放置一段时间即进行后续操作,测定结果_________(填“偏大”、“偏小”或“无影响”),理由是:_______________.
【题目】依据下列实验室制取气体的发生和收集装置回答下列问题。
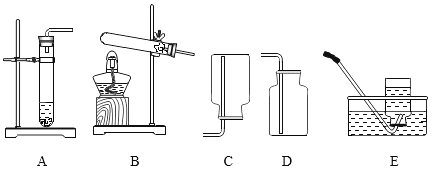
(1)实验室制取二氧化碳的化学方程式是_____;
(2)选择D为收集二氧化碳的装置是因为二氧化碳_____。
为研究实验室制取二氧化碳的适宜条件,进行如下实验。
实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
1g大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
10g盐酸(过量) | 10%盐酸 | 30%盐酸 | 10%盐酸 | 30%盐酸 |
(3)实验甲与实验_____对照,是为了研究固体反应物颗粒大小对反应速率的影响。
(4)上述实验中,另一个影响反应速率的因素是_____。
【题目】某化学兴趣小组欲测定某氯化镁样品中MgCl2的含量(杂质为NaCl),甲、乙、丙三位同学分别取10g样品溶于一定量的水中,得到45.8g、45.8g、50g三份样品溶液,再分别加入溶质质量分数相同的氢氧化钠溶液,所得实验数据如表:
甲同学 | 乙同学 | 丙同学 | |
所用样品溶液质量(g) | 45.8 | 45.8 | 50 |
加入氢氧化钠溶液质量(g) | 70 | 60 | 60 |
反应得到沉淀的质量(g) | 5.8 | 5.8 | 5.8 |
试回答下列问题:
(1) 同学的实验数据显示了MgCl2和NaOH恰好完全反应。
(2)计算MgCl2和NaOH恰好完全反应时所得溶液溶质的质量分数。(结果精确到0. 1%)
【题目】将氯化钠和氯化铁的固体混合物40g完全溶于101.4g水中形成溶液,再将100g一定溶质质量分数的氢氧化钠溶液分5次加入到该溶液中,充分反应后,测得的实验数据如下表所示:
实验次数 | 1 | 2 | 3 | 4 | 5 |
加入氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 |
共生成沉淀的质量/g | 5.35 | 10.7 | m | 21.4 | 21.4 |
求:(1)表中m的值为________。
(2)原混合物中氯化铁的质量___________。
(3)恰好完全反应时,所得溶液的溶质质量分数是____。(写出计算过程,结果精确到0.1%)