题目内容
【题目】工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠。化验员对每批刚生产出的纯碱产品都要进行检测,标示出各种成分的含量后投放市场。在实验室中取22g该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为10%的稀盐酸并不断振荡,首先发生的反应是:Na2CO3+HCl==NaHCO3+NaCl,然后发生的反应是:NaHCO3+HCl==NaCl+CO2↑+H2O。在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示。
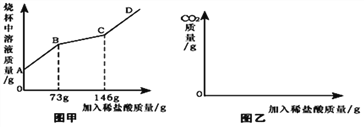
(1)请你根据图甲提供的信息,在图乙的坐标系中画出检测过程中产生CO2的质量随滴加盐酸质量的变化曲线(注意标明二氧化碳、盐酸质量的相应数值)。______________________
(2)计算出22g该样品中各成分的质量为______________。
【答案】 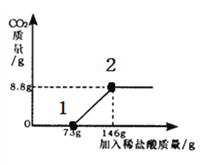 纯碱Na2CO3 21.2g,NaCl 0.8g
纯碱Na2CO3 21.2g,NaCl 0.8g
【解析】(1)开始的45°夹角,说明加入的溶液的质量等于溶液质量增加量,说明过程中无气体或者沉淀产生.当加入73g稀盐酸时,开始放出气体二氧化碳;当稀盐酸的量达146g时,放出二氧化碳气体达最大值;以后再加稀盐酸,不再放出二氧化碳气体;
解:设碳酸氢钠与盐酸反应得到的二氧化碳的质量为x.对应的生成二氧化碳消耗的盐酸的质量为146g-73g=73g
NaHCO3+HCl=NaCl+CO2↑+H2O
36.5 44
73g×10%=7.3g x
![]()
x=8.8g
故答案为:变化曲线,如图,盐酸数值(73g,146g),CO2的数值(0g,8.8g),故图像为: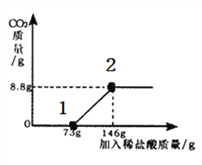
(2)解:设22g样品中Na2CO3质量为x,
Na2CO3+HCl=NaCl+NaHCO3
106 36.5
x 73g×10%
![]()
x=21.2g
22g样品中NaCl的质量为:22g-21.2g=0.8g
答:22g该样品中含碳酸钠21.2g,含氯化钠0.8g。