题目内容
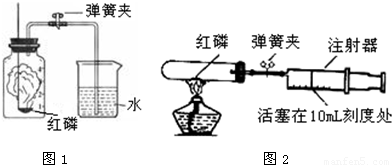
 (1)如图1,用红磷燃烧来测定空气中氧气的含量,实验过程中发生的实验现象是:
(1)如图1,用红磷燃烧来测定空气中氧气的含量,实验过程中发生的实验现象是:①
红磷燃烧产生大量白烟,燃烧一段时间后熄灭,集气瓶壁发热;
红磷燃烧产生大量白烟,燃烧一段时间后熄灭,集气瓶壁发热;
;②打开止水夹后集气瓶里水面上升约1/5
打开止水夹后集气瓶里水面上升约1/5
.此反应的文字表达式为磷+氧气
五氧化二磷
| 点燃 |
磷+氧气
五氧化二磷
.| 点燃 |
(2)如图2,做铁丝在氧气里燃烧的实验时,装氧气的集气瓶里预先放入少量水的作用是:
防止生成的高温熔化物溅落下来炸裂瓶底
防止生成的高温熔化物溅落下来炸裂瓶底
;可以观察到的现象是:铁丝剧烈燃烧,火星四射,放出热量
剧烈燃烧,火星四射,放出热量
生成了一种黑
黑
色的固体.反应的文字表达式是
铁+氧气
四氧化三铁
| 点燃 |
铁+氧气
四氧化三铁
.| 点燃 |
(3)实验室现有5mL、10mL、20mL、50mL、100mL的量筒,现要量取15mL的盐酸,应该选择
20ml
20ml
的量筒,量液时,量筒必须放平,视线要通过量筒
量筒
刻度与量筒内液体的凹液面最低处
凹液面最低处
保持水平.(4)洗过的玻璃仪器内壁附着的水既
不聚成水滴
不聚成水滴
,也不成股
不成股
流下时,表明仪器已洗干净.分析:(1)根据红磷燃烧的生成物和集气瓶内的水,来推测现象;
(2)了解铁丝在氧气中燃烧的现象和注意事项,正确书写文字表达式;
(3)了解量筒的使用方法;
(4)了解玻璃仪器洗刷干净的标准.
(2)了解铁丝在氧气中燃烧的现象和注意事项,正确书写文字表达式;
(3)了解量筒的使用方法;
(4)了解玻璃仪器洗刷干净的标准.
解答:解:(1)红磷燃烧产物是五氧化二磷,属于白色固体颗粒,所以现象是产生大量白烟,放出热量;磷燃烧消耗氧气使瓶内压强减小,在外界大气压的作用下水沿着导管被压入集气瓶内,并进入集气瓶容积的1/5;由此可知氧气约占空气体积的1/5;此反应的文字表达式为:红磷+氧气
五氧化二磷
(2)做铁丝在氧气里燃烧的实验时,装氧气的集气瓶里预先放入少量水的作用是:防止生成的高温熔化物溅落下来炸裂瓶底;可以观察到的现象是:铁丝 剧烈燃烧,火星四射,放出热量生成了一种 黑色的固体.
反应的文字表达式是 铁+氧气
四氧化三铁.
(3)实验室现有5mL、10mL、20mL、50mL、100mL的量筒,现要量取15mL的盐酸,选择量程较接近的量筒,故应该选择 20ml的量筒,量液时,量筒必须放平,视线要通过 量筒刻度与量筒内液体的 凹液面最低处保持水平.
(4)洗过的玻璃仪器内壁附着的水既 不聚成水滴,也 不成股流下时,表明仪器已洗干净.
故答案为:(1)①红磷燃烧产生大量白烟,燃烧一段时间后熄灭,集气瓶壁发热;
②打开止水夹后集气瓶里水面上升约1/5.磷+氧气
五氧化二磷
(2)防止生成的高温熔化物溅落下来炸裂瓶底;剧烈燃烧,火星四射,放出热量;黑色.
铁+氧气
四氧化三铁
(3)20ml; 量筒.凹液面最低处
(4)既不聚成水滴,不成股.
| 点燃 | ||
(2)做铁丝在氧气里燃烧的实验时,装氧气的集气瓶里预先放入少量水的作用是:防止生成的高温熔化物溅落下来炸裂瓶底;可以观察到的现象是:铁丝 剧烈燃烧,火星四射,放出热量生成了一种 黑色的固体.
反应的文字表达式是 铁+氧气
| 点燃 |
(3)实验室现有5mL、10mL、20mL、50mL、100mL的量筒,现要量取15mL的盐酸,选择量程较接近的量筒,故应该选择 20ml的量筒,量液时,量筒必须放平,视线要通过 量筒刻度与量筒内液体的 凹液面最低处保持水平.
(4)洗过的玻璃仪器内壁附着的水既 不聚成水滴,也 不成股流下时,表明仪器已洗干净.
故答案为:(1)①红磷燃烧产生大量白烟,燃烧一段时间后熄灭,集气瓶壁发热;
②打开止水夹后集气瓶里水面上升约1/5.磷+氧气
| 点燃 |
(2)防止生成的高温熔化物溅落下来炸裂瓶底;剧烈燃烧,火星四射,放出热量;黑色.
铁+氧气
| 点燃 |
(3)20ml; 量筒.凹液面最低处
(4)既不聚成水滴,不成股.
点评:本题考查了测定空气中氧气的体积分数的有关问题,了解用红磷测定氧气在空气中含量的实验的注意事项等是解答本题的关键.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目


 氮化镁“跑”到哪儿去了
氮化镁“跑”到哪儿去了