题目内容
【题目】某学生要称量一袋食盐的质量,操作时发现指针朝右偏转,那么他应采取的操作是( )
A.减少食盐B.加砝码C.加食盐D.减砝码
【答案】D
【解析】
使用托盘天平称量药品时应遵循“左物右码”,物体的质量等于砝码的质量加游码的质量。
称量一袋食盐的质量,操作时发现指针朝右偏转,说明砝码加大了,应该减少砝码使天平平衡,故选D。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
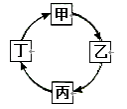
各地期末复习特训卷系列答案【题目】如下表所示。下列说法正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 26 | 8 | 2 | 4 |
反应后质量/g | 1 | X | 16 | 15 |
A.上表中X的值是0B.该反应的基本反应类型是化合反应
C.乙一定是该反应的催化剂D.丙和丁变化的质量比为14:11
【题目】
(1)经过一年化学学习.你可能已经喜欢上了在实验室做实验的感觉。让我们一起再来做实验吧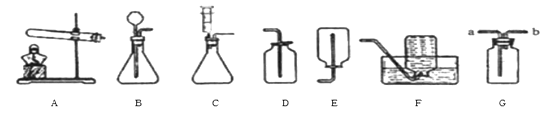
①实验室用装置A制取氧气,若要收集一瓶较纯净的氧气,应选择装置(填字母)若用G装置收集氧气,验满方法为;
②通常情况下,乙炔是一种密度比空气略小.且难溶于水的气体。实验室常用块状碳化钙固体和水反应制取乙炔,该反应在常温下进行且非常剧烈。实验室欲制取乙炔,最好选用的装置组合是(填字母),该发生装置的优点为。
(2)化学兴趣小组同学进行中和反应实验时,将4mL2%的稀硫酸 逐滴滴加到2mL2%的氢氧化钠溶液中,测得溶液的pH变化曲线如下图所示。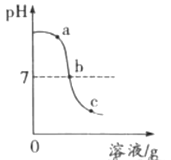
【提出问题】导致溶液pH变化的原因是什么?
【查阅资料】
①溶液的pH是由H+或OH-浓度决定,H+浓度越大,pH越小;OH-浓度越大,pH越大。
②溶液中某种离子浓度非常小时,可忽略不计。
【作出猜想】
猜想Ⅰ:溶液pH变化是因为氢氧化钠溶液被稀释。
猜想Ⅱ:溶液pH变化是因为发生了化学反应。
【进行实验】同学们分成两组分别进行实验。
甲组:同学们将4mL2%的稀硫酸换成 , 逐滴滴加到2mL2%的氢氧化钠溶液中,并测得溶液的pH始终大于7,说明猜想Ⅰ不合理。
乙组:同学们分别取a、b、c三处溶液进行实验。
实验操作 | 实验现象 | 实验分析 |
取适量a处溶液于试管中,加入镁条 | 无气泡产生 | 溶液中几乎不含(填离子符号) |
取适量b处溶液于试管中,加入紫色石蕊溶液 | 溶液中几乎不含H+和OH- | |
取适量c处溶液于试管中,加入 | 溶液中几乎不含OH- |
【实验结论】猜想Ⅱ合理。
(3)【知识拓展】从微观角度分析,中和反应的实质是。