题目内容
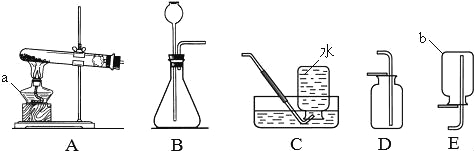
【题目】实验室用如图方法制取氢氧化铜固体。
![]()
(1)步骤①需配制200克溶质质量分数为4%的NaOH溶液,需NaOH固体 克。
(2)请从图中选取步骤②过滤时需要用到的器材 (可多选)。

(3)步骤③中需多次用蒸馏水清洗过滤装置中的滤渣,目的是去除残留在氢氧化铜表面的氯化钠溶液,实验中需要检验清洗后收集到的液体中是否含有氯化钠,写出检验的方法: 。
【答案】
(1)8
(2)ABCD
(3)往收集到的液体中滴加硝酸银溶液,若产生白色沉淀则说明有氯化钠存在
【解析】
试题分析:
(1)溶质质量=溶液质量×溶质的质量分数,配制溶质质量分数4%的NaOH溶液200g,需氢氧化钠的质量=200g×4%=8g;
(2)步骤②过滤时需要用到的器材铁架台、漏斗、烧杯、玻璃棒;
(3)检验检验清洗后收集到的液体中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】在校园科技节上,为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入足量的稀盐酸,每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表(反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑):
时间(分钟) | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
产生气体质量(克) | 0 | 1.80 | 3.00 | 3.60 | 3.96 | 3.96 | 3.96 |
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中钙元素的质量分数。(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大? (可多选)
A.盐酸溶质质量分数过大 B.鸡蛋壳未晾干
C.鸡蛋壳中含有碳酸镁 D.鸡蛋壳未充分研碎