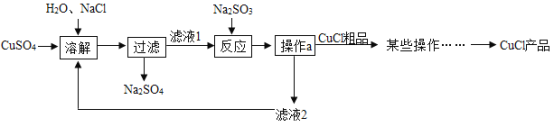
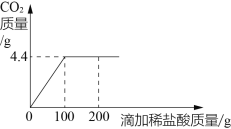
题目内容
【题目】化学兴趣小组按如图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
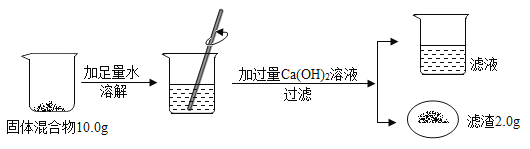
(1)溶解时玻璃棒的作用____,过滤时发现过滤速度较慢可能原因_____
(2)根据题中信息____ (填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数,滤液中含有的离子有____ (填离子符号),滤液倒入下水道前要先处理,需加入的物质是____,
(3)计算固体混合物中Na2CO3的质量分数___。
【答案】加速溶解 滤纸未紧贴漏斗壁(或没有静置,过滤了浑浊的滤液) 不能 Na+、Ca2+、OH- 盐酸(其它合理答案均可) 21.2%
【解析】
(1)溶解时玻璃棒的作用是搅拌加速溶解;速度过慢可能是因为:1.滤纸未紧贴漏斗壁;2. 没有静置,过滤了浑浊的滤液;
(2)因为氢氧化钙溶液为过量,不知是否反应完全,所以不能计算氢氧化钙溶液的溶质质量分数;滤液中应有的溶质为氢氧化钠和氢氧化钙,所以离子为Na+、Ca2+、OH-三种离子;因为溶液为碱性,所以应加入酸性物质,比如盐酸处理;
(3)设样品中含Na2CO3的量为x

混合物中Na2CO3的质量分数为:![]() 。
。

 名校练考卷期末冲刺卷系列答案
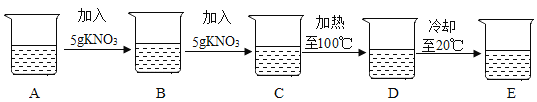
名校练考卷期末冲刺卷系列答案【题目】小明在室温20℃时探究硝酸钾溶于水情况,他进行了如下实验:A烧杯盛有20mL水。
相关资料:
硝酸钾在不同温度下的溶解度如表
温度℃ | 10℃ | 20℃ | 60℃ | 100℃ |
溶解度/g | 20.9 | 31.6 | 110 | 246 |
整个过程溶剂量不变,根据有关资料回答问题:
(1)A→B、B→C操作中需要用___(填一仪器名称);
(2)上述实验过程中属于饱和溶液的是(填字母)___;
(3)在B、C、D、E中,溶液的溶质质量分数最小是___(填字母);
(4)现在需要配制溶质质量分数为60%的硝酸钾饱和溶液,温度必须控制在___范围中;
(5)在农业生产中硝酸钾属于___;
A 氮肥 B 磷肥 C 钾肥 D 复合肥