题目内容
【题目】(8分)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示:
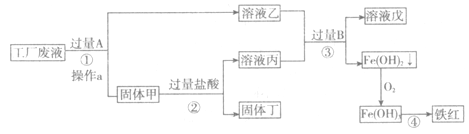
回答下列问题:
(1)操作a的名称是__________,操作a要用到玻璃棒,其作用是___________________。
(2)工厂废液中加入过量A的化学反应方程为______________________________。
(3)已知氢氧化铁在加热条件下会分解生成两种氧化物。根据所提供的信息请写出步骤④的化学方程式是________________________________________。
(4)溶液乙中的金属离子是__________(写离子符号)。
(5)步骤①②③中所发生的化学反应,其中属于复分解反应的是__________(填序号)。
【答案】(1)过滤 引流(2)Fe+CuCl2==FeCl2+Cu(3)2Fe(OH)3![]() Fe2O3 + 3H2O
Fe2O3 + 3H2O
(4)Na+ Fe2+ (5)③
【解析】
试题分析:操作a能得到固体所以名称是过滤,要用到玻璃棒,其作用是引流,要从废液中回收铜并得到铁红(主要成分Fe2O3),因此工厂废液中加入过量铁粉,置换出其中的铜元素,同时变为亚铁离子进入溶液,加入铁粉后,能够置换出其中的铜变为亚铁离子,但是钠不会被置换,所以溶液中一定有Na+ Fe2+,反应中①和②都是置换反应,所以③属于复分解反应。

练习册系列答案
相关题目