题目内容
(2013?泰州)现有下列四套常见的实验装置,请按要求填写下列有关空格:
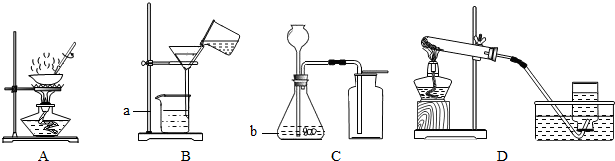
(1)写出标号仪器的名称:a
(2)除去食盐水中的少量泥沙,应选用的一套装置是
(3)在进行 A 装置相关操作时,通常在实验桌上放一石棉网.该石棉网在此实验过程中的用途是
(4)用装置 C 可制备 O2、CO2等气体.请写出用该装置制取 O2 的化学方程式
A.装置可能漏气 B.药品用量可能不足 C.导气管未伸到集气瓶底部 D.药品可能失效
(5)实验室可用 D 装置制取甲烷气体,则下列说法错误的是
A.制取甲烷的药品是固体 B.甲烷在水中溶解能力小 C.甲烷不与水反应 D.甲烷密度大于空气.

(1)写出标号仪器的名称:a
铁架台
铁架台
,b锥形瓶
锥形瓶
.(2)除去食盐水中的少量泥沙,应选用的一套装置是
B
B
(填序号),要正确完成该操作还需要的仪器名称是.(3)在进行 A 装置相关操作时,通常在实验桌上放一石棉网.该石棉网在此实验过程中的用途是
放置加热后的蒸发皿
放置加热后的蒸发皿
;石棉网属于复合
复合
(选填“复合”或“合成”)材料.(4)用装置 C 可制备 O2、CO2等气体.请写出用该装置制取 O2 的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;实验中始终未能检验到 O2 已集满,下列解释不合理的是
| ||
C
C
(填序号)A.装置可能漏气 B.药品用量可能不足 C.导气管未伸到集气瓶底部 D.药品可能失效
(5)实验室可用 D 装置制取甲烷气体,则下列说法错误的是
D
D
(填序号)A.制取甲烷的药品是固体 B.甲烷在水中溶解能力小 C.甲烷不与水反应 D.甲烷密度大于空气.
分析:(1)根据常见仪器的名称进行解答;
(2)根据泥沙难溶于水以及过滤的注意事项进行解答;
(3)根据蒸发过程中石棉网的用途以及石棉网属于复合材料进行解答;
(4)根据装置C适用于固体和液体混合不需要加热的反应进行解答;
(5)根据D装置的特点和收集方法进行解答.
(2)根据泥沙难溶于水以及过滤的注意事项进行解答;
(3)根据蒸发过程中石棉网的用途以及石棉网属于复合材料进行解答;
(4)根据装置C适用于固体和液体混合不需要加热的反应进行解答;
(5)根据D装置的特点和收集方法进行解答.
解答:解:(1)标号仪器的名称:a铁架台,b锥形瓶;故填:铁架台;锥形瓶;
(2)泥沙难溶于水,所以除去食盐水中的少量泥沙可用过滤的方法;要正确完成该操作还需要的仪器名称是玻璃棒;故填:B;玻璃棒;
(3)蒸发过程中石棉网的用途,放置加热后的蒸发皿;石棉网属于复合材料;故填:放置加热后的蒸发皿;复合;
(4)装置C适用于固体和液体混合不需要加热的反应,所以用该装置制取O2的化学方程式2H2O2
2H2O+O2↑;实验中始终未能检验到 O2 已集满,可能是装置可能漏气、药品用量可能不足、药品可能失效,而导气管未伸到集气瓶底部不会导致这种结果;故填:2H2O2
2H2O+O2↑;C;
(5)A.根据D装置适用于固体,所以制取甲烷的药品是固体,故正确;B.甲烷用排水法收集,说明甲烷在水中溶解能力小,故正确 C.甲烷用排水法收集,说明甲烷也不与水反应,故正确;D.D装置不能说明甲烷密度大于空气,事实甲烷的密度小于空气的密度,故错误.故填:D.
(2)泥沙难溶于水,所以除去食盐水中的少量泥沙可用过滤的方法;要正确完成该操作还需要的仪器名称是玻璃棒;故填:B;玻璃棒;
(3)蒸发过程中石棉网的用途,放置加热后的蒸发皿;石棉网属于复合材料;故填:放置加热后的蒸发皿;复合;
(4)装置C适用于固体和液体混合不需要加热的反应,所以用该装置制取O2的化学方程式2H2O2
| ||
| ||
(5)A.根据D装置适用于固体,所以制取甲烷的药品是固体,故正确;B.甲烷用排水法收集,说明甲烷在水中溶解能力小,故正确 C.甲烷用排水法收集,说明甲烷也不与水反应,故正确;D.D装置不能说明甲烷密度大于空气,事实甲烷的密度小于空气的密度,故错误.故填:D.
点评:通过对改进实验方案意义的分析,完成对方案的评价,体现实验的分析能力.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目