题目内容
【题目】钠元素是化学研究的重要内容.已知:过氧化钠(固体,化学式为Na2O2)与水反应生成氢氧化钠和氧气;过氧化钠与二氧化碳反应生成碳酸钠和氧气.上述反应涉及的三种含钠化合物在社会生产发展中起着重要的作用.
(1)钠的原子结构示意图为 . 钠元素位于元素周期表第三周期的(填“开头”、“中间”、“靠近尾部”或“结尾”)处.
(2)甲、乙、丙分别为上述三种含钠化合物的一种,它们之间的转化关系如图1所示.其中反应①的发生需要二氧化碳,且丙中氧的质量分数为40%.写出以下反应的化学方程式: 反应②为;反应③为 .
(3)以下是化学兴趣小组利用如图2所示实验装置进行制取氧气的探究活动. 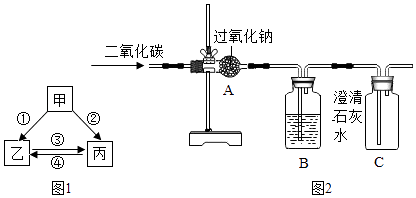
①若CO2未被Na2O2完全吸收,装置B中的实验现象为 .
②取上述实验后装置A中固体,加入足量水,有气泡产生,并得到无色溶液.同学们分析后得出溶液中成分.如何检验所得溶液中含有的溶质?(简要写出实验步骤与现象)
(4)若将21.2g久置于空气中的氢氧化钠固体样品加入足量的稀硫酸,产生CO2气体4.4g.请计算样品中碳酸钠的质量是多少?
【答案】
(1) ;开头
;开头
(2)2Na2O2+2H2O=4NaOH+O2↑;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)澄清石灰水变浑浊;取样,加入足量氯化钙溶液,静置,然后向上层清液中滴加无色酚酞试液,实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠;
(4)解:设碳酸钠的质量为x.
Na2CO3+H2SO4=Na2SO4+H2O+ | CO2↑ |
106 | 44 |
x | 4.4g |
![]() =
= ![]() ,x=10.6g
,x=10.6g
答:碳酸钠的质量为10.6g.
【解析】解:(1)钠的原子结构示意图为  .钠元素原子最外层电子数是1,位于元素周期表第三周期的开头处.(2)反应①的发生需要二氧化碳,则①是过氧化钠与二氧化碳反应,丙中氧的质量分数为40%,则丙是氢氧化钠,则反应②为过氧化钠与水反应生成氢氧化钠和氧气,反应③可为氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠.(3)①若CO2未被Na2O2完全吸收,装置B中的实验现象为澄清石灰水变浑浊.②取样,加入足量氯化钙溶液,静置,然后向上层清液中滴加无色酚酞试液,实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠.
.钠元素原子最外层电子数是1,位于元素周期表第三周期的开头处.(2)反应①的发生需要二氧化碳,则①是过氧化钠与二氧化碳反应,丙中氧的质量分数为40%,则丙是氢氧化钠,则反应②为过氧化钠与水反应生成氢氧化钠和氧气,反应③可为氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠.(3)①若CO2未被Na2O2完全吸收,装置B中的实验现象为澄清石灰水变浑浊.②取样,加入足量氯化钙溶液,静置,然后向上层清液中滴加无色酚酞试液,实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠.
答:碳酸钠的质量为10.6g.
故填:(1)  ;开头;(2)2Na2O2+2H2O=4NaOH+O2↑;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;(3)澄清石灰水变浑浊;取样,加入足量氯化钙溶液,静置,然后向上层清液中滴加无色酚酞试液,实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠;
;开头;(2)2Na2O2+2H2O=4NaOH+O2↑;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;(3)澄清石灰水变浑浊;取样,加入足量氯化钙溶液,静置,然后向上层清液中滴加无色酚酞试液,实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠;
④答:碳酸钠的质量为10.6g.
【考点精析】关于本题考查的二氧化碳的化学性质和根据化学反应方程式的计算,需要了解化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应;各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
