题目内容
【题目】某同学为测定氯化钠和氯化镁混合物的组成情况,某小组进行了下实验。请回答下列问题:
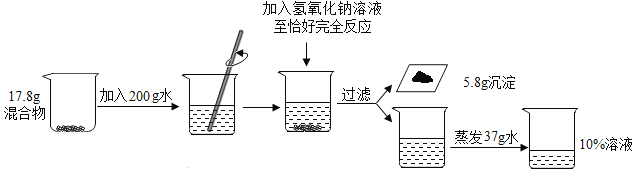
(1)实验中发生反应的化学方程式为_____;
(2)求解混合物中发生反应的物质质量(x)的比例式为_____;
(3)混合物中氯化钠和氯化镁质量的最简整数比为_____;
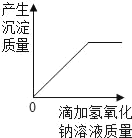
(4)在滴加氢氧化钠溶液的过程中,用数据说明烧杯中各溶质质量的变化情况_____;
(5)所用氢氧化钠溶液中溶质质量分数为_____。
【答案】MgCl2+2NaOH=2NaCl+Mg(OH)2↓ ![]() 83:95 氯化镁的质量从9.5g逐渐成0,而氯化钠的质量从8.3g变成20g 32%
83:95 氯化镁的质量从9.5g逐渐成0,而氯化钠的质量从8.3g变成20g 32%
【解析】
(1)实验中是氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁,对应的化学方程式为 MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(2)(3)(5)设氯化镁的质量为x,所用氢氧化钠溶液中溶质的质量为y,生成的氯化钠的质量为z

![]()
x=9.5g
y=8g
z=11.7g
混合物中发生反应的物质质量(x)的比例式为![]()
混合物中氯化钠和氯化镁质量的最简整数比为(17.8g﹣9.5g):9.5g=83:95;
所用氢氧化钠溶液的质量为![]() +37g+5.8g﹣200g﹣17.8g=25g
+37g+5.8g﹣200g﹣17.8g=25g
所用氢氧化钠溶液中溶质质量分数为![]() ×100%=32%。
×100%=32%。
(4)在滴加氢氧化钠溶液的过程中,用数据说明烧杯中各溶质质量的变化情况 氯化镁的质量从9.5g逐渐成0,而氯化钠的质量从8.3g变成17.8g﹣9.5g+11.7g=20g;

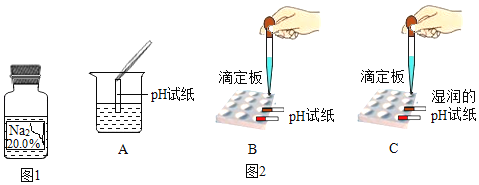
【题目】实验室中有一瓶标签受损的无色溶液,如图1所示,老师提示这是一瓶初中常用的溶液,要求同学们确认其溶质成分。
【提出猜想】①氯化钠②氢氧化钠③硫酸钠④碳酸钠
【查阅资料】氯化钠和硫酸钠溶液pH=7可溶性硫酸盐遇到可溶性的钡盐会产生白色沉淀。
【讨论分析】经过讨论,同学们一致认为猜想_____(填序号)不成立,其原因是_____。
【实验探究】为了进一步确认其成分,同学们继续进行探究:
实验步骤 | 实验现象 | 实验结论 |
(1)取该溶液少许于试管中,向其中滴加稀盐酸 | 无明显现象 | 猜想_____不成立 |
(2)取该溶液少许于试管中,向其中滴加氯化钡溶液 | _____________ | 猜想③成立 |
假如猜想④成立,写出(1)中发生的反应方程式_____。
【反思与交流】有同学提出用测pH的方法也可以确定该无色溶液,如图2所示是几位同学的实验过程,其中正确的是_____。