题目内容
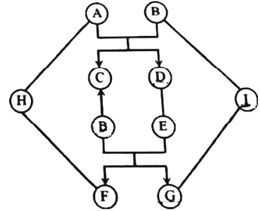
【题目】图中A~I是初中化学常见的物质,且分别是由H、O、Na、Al、S、Cl、Cu、Ba中的一种或几种元素组成的。C为紫红色固体;E能与油脂反应,在生活中可用来去除油污;B、D、G、I为相同类别的化合物。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
(1)写出化学式E:_____________。
(2)写出化学方程式:
A与B的反应_______________________________________;
H与F的反应_______________________________________;
G与I的反应_______________________________________。
【答案】 NaOH 2Al+3CuSO4=Al2(SO4)3+3Cu Cu(OH)2+2HCl===CuCl2+2H2O 或Cu(OH)2+H2SO4===CuSO4+2H2O Na2SO4+BaCl2===BaSO4↓ +2NaCl
【解析】图中A~I是初中化学常见的物质,且分别是由H、O、Na、Al、S、Cl、Cu、Ba中的一种或几种元素组成的。C为紫红色固体,则C是铜。E能与油脂反应,在生活中可用来去除油污,则E是氢氧化钠。由于A与B反应生成铜,B、D、G、I为相同类别的化合物。因此A与B的反应为金属与铜的盐溶液反应。故A为铝,B为硫酸铜溶液。又E是氢氧化钠,且F与G反应生成B、E。B、D、G、I为相同类别的化合物。故G是硫酸钠,F是氢氧化铜。又G能与I反应且G中含有硫酸根,G、I为相同类别的化合物。故I为氯化钡。F是氢氧化铜能与H反应,H也能与A反应,且A 是铝。因此H是酸(HCl或H2SO4)。
(1)E的化学式为NaOH;
(2)A与B的反应2Al+3CuSO4=Al2(SO4)3+3Cu ;
H与F的反应Cu(OH)2+2HCl===CuCl2+2H2O 或Cu(OH)2+H2SO4===CuSO4+2H2O;
G与I的反应Na2SO4+BaCl2===BaSO4↓ +2NaCl。

【题目】地球上的金属资源广泛地存在于地壳和海洋中。
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
冶炼方法 | 主要原理 | 代表金属 |
电解法 | 熔融的金属化合物在通电的条件下分解 | 钠、铝 |
热还原法 | 金属氧化物与一氧化碳(或碳等)在高温的条件下反应 | 铁、铜 |
热分解法 | 金属氧化物在加热的条件下分解 | 汞、银 |
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
①电解熔融的氯化镁可以得到镁。分别写出氯化镁和镁的化学式,并标出其中镁元素的化合价:___________、___________。
②炼铁的原理是利用一氧化碳和氧化铁的反应,写出该反应的化学方程式:_________________________。
③二百多年前,拉瓦锡研究空气的成分时,加热红色的氧化汞粉末得到了银白色的汞,写出该反应的化学方程式:_______________________。
④从含有铅元素并有开采价值的矿石中提取铅,应选择上述方法中的_______________。
(2)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(硫酸的质量分数为20%),与足量的废铁屑反应,可生产硫酸亚铁的质量是多少?(写出计算过程)____________