题目内容
已知某粗盐样品中含有少量MgCl2、CaCl2及不溶性杂质.某研究性学习小组对该粗盐的提纯进行了探究,设计如下实验流程,请根据图示回答下列问题:( 20℃时,部分物质的溶解性见表)
| Na+ | Mg2+ | Ca2+ | |
| OH- | 溶 | 难溶 | 微溶 |
| Cl- | 溶 | 溶 | 溶 |
| CO32- | 溶 | 微溶 | 难溶 |
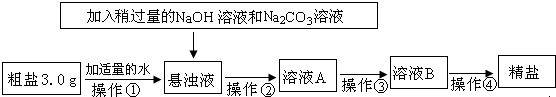
(1)操作①中需要使用的玻璃仪器有:烧杯、________.操作②的名称为________.若在操作②结束后发现溶液A仍浑浊,应采取的措施是________.
(2)操作③是在加热条件下不断滴加稀盐酸至溶液的pH=7.该操作的目的是________.
(3)操作④是将溶液B倒入________(填仪器名称)中,加热并不断搅拌,直到________时(填现象),停止加热.
解:(1)粗盐提纯首先要溶解,溶解要用到的仪器有烧杯、玻璃棒;当加入稍过量的氢氧化钠溶液和碳酸钠溶液后,可与杂质MgCl2、CaCl2生成不溶于水的氢氧化镁沉淀和碳酸钙沉淀,操作②是过滤掉这些沉淀;若在操作②结束后发现溶液A仍浑浊,应采取的措施是重新过滤.
故答案为:玻璃棒;过滤;再过滤.
(2)因为氢氧化钠溶液和碳酸钠溶液过量,所以应设法除去.
故答案为:除去过量的Na2CO3和NaOH;
(3)操作④是蒸发结晶,蒸发时,将溶液B倒入蒸发皿中,如果蒸发皿中出现较多固体时,应停止加热,靠余热把水蒸干.加热过程中,应不断用玻璃棒搅拌,防止液滴飞溅.
故答案为:蒸发皿;蒸发皿中出现较多固体.
分析:(1)根据粗盐的提纯要经过溶解、过滤、蒸发、结晶的几个步骤考虑;
(2)根据加入的氢氧化钠溶液和碳酸钠溶液过量,分析操作③在加热条件下不断滴加稀盐酸至溶液的pH=7的目的;
(3)根据操作④是蒸发结晶分析.
点评:本题主要考查混合物分离过程中的溶解、过滤、蒸发等内容,题目不难,但需要同学们的细心分析.
故答案为:玻璃棒;过滤;再过滤.
(2)因为氢氧化钠溶液和碳酸钠溶液过量,所以应设法除去.
故答案为:除去过量的Na2CO3和NaOH;
(3)操作④是蒸发结晶,蒸发时,将溶液B倒入蒸发皿中,如果蒸发皿中出现较多固体时,应停止加热,靠余热把水蒸干.加热过程中,应不断用玻璃棒搅拌,防止液滴飞溅.
故答案为:蒸发皿;蒸发皿中出现较多固体.
分析:(1)根据粗盐的提纯要经过溶解、过滤、蒸发、结晶的几个步骤考虑;
(2)根据加入的氢氧化钠溶液和碳酸钠溶液过量,分析操作③在加热条件下不断滴加稀盐酸至溶液的pH=7的目的;
(3)根据操作④是蒸发结晶分析.
点评:本题主要考查混合物分离过程中的溶解、过滤、蒸发等内容,题目不难,但需要同学们的细心分析.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目



 已知某粗盐样品中含有少量MgCl2、CaCl2和不溶性杂质,通过如图步骤来制取精盐.
已知某粗盐样品中含有少量MgCl2、CaCl2和不溶性杂质,通过如图步骤来制取精盐.