题目内容
【题目】小苏打(碳酸氢钠)在日常生活中有广泛的用途,工业上制取小苏打有多种方法,其中有一种是气相固碳法,其利用的原理是:Na2CO3 + H2O + CO2 =2NaHCO3
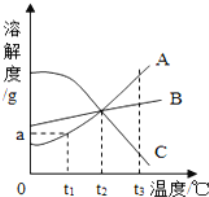
资料: 碳酸钠和碳酸氢钠的溶解度表(一个标准大气压下)(部分)
温度/℃ | 0 | 15 | 20 | 30 | 40 | 50 | 60 |
碳酸氢钠溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 | 12.7 | 14.45 | 16.4 |
碳酸钠溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
学校实验小组验证反应原理,在室温为15℃时,同学们将10g氢氧化钠固体完全溶解溶于80g水中,而后匀速的通入二氧化碳气体。同时用传感器测定溶液的pH变化,同时用数据采集器记录并绘制图像如图2所示。
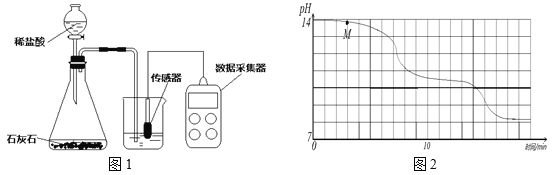
⑴ 图1所示实验中,用“分液漏斗”而不用“长颈漏斗”其原因是______________;
⑵ 通过图像分析,小苏打溶液是显________(填“酸性”、“中性”或“碱性”),图像中M点处发生的主要化学反应方程式为________________;
⑶ 为了确定M处溶液的成分,同学们进行如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
① | 滴入________ | 溶液变红 | 有________物质 |
② | 加入________ | ______________ |
⑷ 实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时烧杯中就可观察到的现象有________。
【答案】 便于控制生成二氧化碳的速率 碱性 2NaOH+CO2==Na2CO3+H2O 滴入无色酚酞 加入过量的 CaCl2溶液 有白色沉淀生成,且红色不消失 既有氢氧化钠,又有碳酸钠 有不溶物析出
【解析】(1)由于题目要求匀速的通入二氧化碳气体,使用分液漏斗便于控制稀盐酸滴加的速率,从而控制生成二氧化碳的速率。
(2)通过图像可知,溶液的pH值始终大于7,可见当二氧化碳足量时,生成的碳酸氢钠溶液也显碱性,图像中M点处发生的主要化学反应为氢氧化钠与二氧化碳反应生成碳酸钠和水,方程式为2NaOH+CO2==Na2CO3+H2O;
(3)为了确定M处溶液的成分,即验证溶液中溶质为氢氧化钠或氢氧化钠和碳酸钠,再加入滴入无色酚酞溶液,如果溶液变红色,说明溶液显碱性,再加入过量的 CaCl2溶液或BaCl2溶液,除去碳酸根离子,将其转化为碳酸钙或碳酸钡的白色沉淀,并且溶液仍未红色,说明溶液中既有氢氧化钠,又有碳酸钠;
(4)实验过程中,同学们发现18min后溶液的pH基本不再变化,此时溶液中溶液转化为碳酸氢钠,根据2NaOH+CO2==Na2CO3+H2O;Na2CO3 + H2O + CO2 =2NaHCO3可知,10g氢氧化钠转化为碳酸氢钠时质量大于10g,水的质量仍未80g,由于15℃时,碳酸氢钠的溶解度较小(8.72g),所以碳酸氢钠溶液达到饱和,进而析出。

【题目】物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题。
(1)某固体可以用于人工降雨,组成该固体的元素为______。
(2)A、B两种物质分别由1种或2种元素组成,进行如下实验。
物质 | A | B |
滴加的物质 | 稀盐酸 | 稀盐酸 |
现象 | 生成浅绿色溶液和一种可燃性气体 | 生成黄色溶液 |
① A物质的化学式为_______。
② B中滴加稀盐酸,发生反应的化学方程式为______。
(3)如图所示,打开止水夹和胶塞,向放有少量固体C的甲中加入足量D的溶液,塞紧胶塞,观察到甲中有气泡,乙中溶液变浑浊。关闭止水夹,甲中无色液体流入乙中,乙中有气泡产生,浑浊液变为无色溶液。乙中溶液变浑浊反应的化学方程式为______;甲中无色液体流入乙中时所含溶质可能的组成为___。